
| Phosphor pentoxide | |||
|---|---|---|---|
|
| |||
| Tên khác | Diphosphorus pentoxide Phosphorus(V) oxide Phosphoric anhydride Tetraphosphorus decaoxide Tetraphosphorus decoxide | ||
| Nhận dạng | |||
| Số CAS | 1314-56-3 | ||
| PubChem | 14812 | ||
| ChEBI | 37376 | ||
| Số RTECS | TH3945000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| Thuộc tính | |||
| Công thức phân tử | P4O10 | ||
| Bề ngoài | bột trắng dễ chảy rữa mùi hăng | ||
| Khối lượng riêng | 2,39 g/cm³ | ||
| Điểm nóng chảy | 340 °C (613 K; 644 °F) | ||
| Điểm sôi | 360 °C (633 K; 680 °F) | ||
| Độ hòa tan trong nước | thủy phân tỏa nhiệt | ||
| Áp suất hơi | 1 mmHg @ 385 °C | ||
| Các nguy hiểm | |||
| MSDS | MSDS | ||
| Phân loại của EU | không liệt kê | ||
| NFPA 704 |
1
3
3
| ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
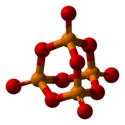
Oxit phospho pentoxide hay Diphospho pentoxide là một hợp chất hóa học có công thức phân tử P4O10 (thường được gọi là P2O5 dựa trên công thức thực nghiệm). Đây là dạng rắn màu trắng, là anhydrite của acid phosphoric, là chất hút ẩm mạnh và chất khử nước.
Diphospho pentoxide tinh khiết ở ít nhất 4 dạng (hoặc 4 đa hình). Dạng phổ biến nhất, một trạng thái giả bền, được biểu diễn trong hình, bao gồm các phân tử P4O10. Lực van der Waals yếu liên kết các phân tử lại với nhau trong một cấu trúc tinh thể hình lục giác (mặc dù sự đối xứng cao của các phân tử, cấu trúc tinh thể không hoàn toàn đều). Cấu trúc lồng P4O10 có liên quan chặt chẽ đến adamantane với nhóm điểm đối xứng Td. Nó gần gũi với anhydrite tương ứng của acid phosphorơ, P4O6. Anhydrite thứ hai này thiếu nhóm oxo ở cực trên. Mật độ của nó là 2,30 g/cm³. Nó sôi ở 423 °C dưới áp suất khí quyển; nếu nung nó nhanh hơn, nó có thể phát nổ. Dạng này có thể được tạo ra bằng cách làm lạnh nhanh hơi oxit phospho pentoxide, kết quả là một chất rắn cực kỳ hút ẩm.
Đặc tính hóa học
Phản ứng với base (tùy theo tỷ lệ mol) tạo ra muối axit hoặc muối trung tính
- P2O5 + 2NaOH + H2O → 2NaH2PO4
- P2O5 + 4NaOH → 2Na2HPO4 + H2O
- P2O5 + 6NaOH → 2Na3PO4 + 3H2O
Phản ứng với nước
- P2O5 + 3H2O → 2H3PO4
Ứng dụng
Oxit phospho pentoxide là một chất khử nước mạnh, như được cho thấy bởi nhiệt phát ra trong quá trình thủy phân:
- P4O10 + 6 H2O → 4 H3PO4 (–177 kJ)
Tuy nhiên, việc sử dụng nó để làm khô bị hạn chế do nó có xu hướng tạo ra một lớp phủ bảo vệ dạng nhớt ngăn cản sự khử nước tiếp theo của các vật liệu khác. Hạt P4O10 được sử dụng trong các thiết bị hút ẩm.
Phù hợp với khả năng hút ẩm mạnh của nó, P4O10 được sử dụng trong tổng hợp hữu cơ để khử nước. Ứng dụng quan trọng nhất của nó là chuyển đổi các amit bậc nhất thành các nitril:
- P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
Trong phương trình, P4O9(OH)2 là công thức lý tưởng hóa của các sản phẩm không xác định được hình thành từ quá trình hydrat hóa P4O10.
Bên cạnh đó, khi phối hợp với acid cacboxylic, phản ứng tạo ra anhydrit hữu cơ tương ứng:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
'Thuốc thử Onodera' là dung dịch của P4O10 trong DMSO, được sử dụng để oxy hóa các loại rượu. Phản ứng này tương tự như phản ứng Swern.
Khả năng hút ẩm của P4O10 đủ mạnh để chuyển đổi nhiều acid vô cơ thành các anhydrit của chúng, ví dụ như: HNO3 được chuyển thành N2O5; H2SO4 thành SO3; HClO4 thành Cl2O7; HCF3SO3 thành (CF3)2S2O5.
Nguy hiểm
Phosphor pentoxide không dễ cháy nhưng phản ứng dữ dội với nước và các chất có chứa nước như gỗ hay bông, giải phóng nhiều nhiệt và có thể gây cháy. Đây là chất ăn mòn mạnh với nhiều kim loại và rất kích thích – có thể gây bỏng nghiêm trọng đối với mắt, da, màng nhầy, đường hô hấp ngay cả khi ở nồng độ thấp chỉ 1 mg/m³.
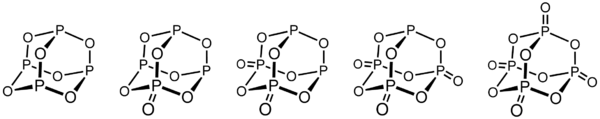
Các oxit phosphor liên quan
Nằm giữa P4O6 và P4O10, các oxit phosphor có cấu trúc trung gian có tầm quan trọng trong kinh tế và thương mại
Hợp chất phosphor |
|---|
