| pepsin A | |||
|---|---|---|---|
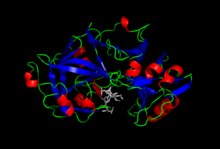
Pepsin trong phức tạp với pepstatin. | |||
| Mã định danh (ID) | |||
| Mã EC | 3.4.23.1 | ||
| Mã CAS | 9001-75-6 | ||
| Các dữ liệu thông tin | |||
| IntEnz | IntEnz view | ||
| BRENDA | BRENDA entry | ||
| ExPASy | NiceZyme view | ||
| KEGG | KEGG entry | ||
| MetaCyc | chu trình chuyển hóa | ||
| PRIAM | profile | ||
| Các cấu trúc PDB | RCSB PDB PDBj PDBe PDBsum | ||
| Bản thể gen | AmiGO / EGO | ||
| |||
| pepsin B | |||
|---|---|---|---|
| Mã định danh (ID) | |||
| Mã EC | 3.4.23.2 | ||
| Mã CAS | 9025-48-3 | ||
| Các dữ liệu thông tin | |||
| IntEnz | IntEnz view | ||
| BRENDA | BRENDA entry | ||
| ExPASy | NiceZyme view | ||
| KEGG | KEGG entry | ||
| MetaCyc | chu trình chuyển hóa | ||
| PRIAM | profile | ||
| Các cấu trúc PDB | RCSB PDB PDBj PDBe PDBsum | ||
| |||
| pepsin C (gastricsin) | |||
|---|---|---|---|
| Mã định danh (ID) | |||
| Mã EC | 3.4.23.3 | ||
| Mã CAS | 9012-71-9 | ||
| Các dữ liệu thông tin | |||
| IntEnz | IntEnz view | ||
| BRENDA | BRENDA entry | ||
| ExPASy | NiceZyme view | ||
| KEGG | KEGG entry | ||
| MetaCyc | chu trình chuyển hóa | ||
| PRIAM | profile | ||
| Các cấu trúc PDB | RCSB PDB PDBj PDBe PDBsum | ||
| |||
Pepsin là một enzyme chịu trách nhiệm phân hủy protein thành các peptide nhỏ hơn, còn gọi là protease. Được sản xuất trong dạ dày, pepsin đóng vai trò chủ chốt trong hệ tiêu hóa của con người và nhiều động vật khác, giúp tiêu hóa protein từ thức ăn. Pepsin là một trong ba protease chính của hệ tiêu hóa con người, cùng với chymotrypsin và trypsin. Các enzyme này cắt đứt liên kết giữa các amino acid, phân giải protein thành các peptide và amino acid để ruột non dễ dàng hấp thụ dinh dưỡng. Pepsin đặc biệt hiệu quả trong việc phân cắt các liên kết peptide kỵ nước với amino acid thơm như phenylalanine, tryptophan và tyrosine.
Pepsin bắt nguồn từ proenzyme, pepsinogen, được tiết ra từ các tế bào chính trong dạ dày. Khi hòa với axit hydrochloric trong dạ dày, pepsinogen chuyển hóa thành pepsin. Pepsin là một protease aspartic, sử dụng một aspartate làm xúc tác tại hoạt điểm của nó.
Lịch sử
Pepsin là một trong những enzyme đầu tiên được phát hiện. Nó được phát hiện bởi nhà nghiên cứu người Đức Theodor Schwann vào năm 1836. Schwann đã đặt tên enzyme này theo từ tiếng Hy Lạp πέψις pepsis, có nghĩa là 'tiêu hóa' (từ πέπτειν peptein có nghĩa là 'digest'). Thời gian đó, các nhà khoa học bắt đầu khám phá nhiều hợp chất sinh hóa mới, và pepsin là một trong số đó. Nó được xác định là chất có tính axit chuyển đổi thức ăn dựa trên vật liệu hòa tan trong nước.
Năm 1928, pepsin trở thành một trong những enzyme đầu tiên được tinh chế thành dạng tinh thể nhờ John H. Northrop. Ông đã ứng dụng pepsin trong các quy trình lọc máu, lọc nước và làm mát.
Tiền thân
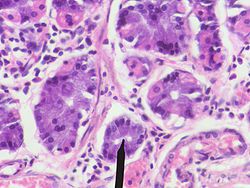
Pepsin được biểu hiện dưới dạng zymogen gọi là pepsinogen, chứa cấu trúc chính với 44 amino acid. Trong dạ dày, các tế bào chính sản xuất pepsinogen. Zymogen này được kích hoạt bởi axit hydrochloric (HCl) từ các tế bào thành trong niêm mạc dạ dày. Hormone gastrin và dây thần kinh phế vị kích thích sự tiết pepsinogen và HCl khi thức ăn được tiêu hóa. HCl làm cho môi trường dạ dày có tính axit, giúp pepsinogen chuyển hóa thành pepsin hoạt động. Sự phân cắt 44 amino acid từ pepsinogen tạo ra pepsin, do đó pepsinogen là tiền thân của pepsin.
Hoạt động và ổn định
Pepsin hoạt động hiệu quả nhất trong môi trường axit từ 37°C đến 42°C. Hoạt điểm chính của enzyme này được tổng hợp và hoạt động trong dạ dày với pH từ 1,5 đến 2. Pepsin có khả năng tiêu hóa lên đến 20% nhóm amide bằng cách tách ưu tiên N-terminal của các amino acid thơm như phenylalanine, tryptophan và tyrosine. Pepsin thể hiện sự phân cắt ưu tiên với chất kỵ nước, vòng thơm, tại các vị trí P1 và P1'. Nếu có amino acid chứa lưu huỳnh gần với bó peptide, quá trình thủy phân sẽ nhạy cảm hơn. Pepsin cắt các peptide như PheVal, GlnHis, GluAla, AlaLeu, LeuTyr, TyrLeu, GlyPhe, Phe. Pepsin hoạt động tối ưu ở pH 2.0 và không hoạt động ở pH 6.5 trở lên, tuy nhiên enzyme này không hoàn toàn bị biến tính cho đến khi pH đạt 8.0, do đó pepsin trong dung dịch với pH lên đến 8.0 có thể được kích hoạt lại khi có sự tái axit hóa. Sự ổn định của pepsin ở pH cao có ảnh hưởng quan trọng đối với bệnh trào ngược hầu-thanh quản, vì pepsin vẫn tồn tại ở thanh quản sau sự kiện trào ngược dạ dày. Ở pH trung bình của vùng hầu thanh quản (pH = 6.8), pepsin không hoạt động nhưng có thể được kích hoạt lại sau các sự kiện axit trào ngược tiếp theo, gây tổn thương cho các mô xung quanh.
Trào ngược hầu thanh quản
Pepsin là một trong những nguyên nhân chính gây tổn thương niêm mạc trong trào ngược hầu thanh quản. Pepsin vẫn tồn tại ở thanh quản (pH 6.8) sau một sự kiện trào ngược dạ dày. Dù enzyme hoạt động trong môi trường này, pepsin vẫn ổn định và có thể được kích hoạt lại sau các sự kiện trào ngược axit tiếp theo. Sự tiếp xúc của niêm mạc thanh quản với pepsin có thể làm giảm biểu hiện của protein bảo vệ, dẫn đến tăng độ nhạy cảm và tổn thương thanh quản.
Pepsin cũng có thể gây tổn thương niêm mạc dạ dày trong trường hợp trào ngược dạ dày có tính axit yếu hoặc không sinh axit. Trào ngược yếu hoặc không axit liên quan đến các triệu chứng và tổn thương niêm mạc. Trong điều kiện không sinh axit (pH trung tính), pepsin được hấp thu bởi các tế bào đường hô hấp trên như thanh quản và hầu dưới qua quá trình gọi là receptor-mediated endocytosis (nhập bào nhờ receptor). Các thụ thể mà pepsin sử dụng để nhập bào hiện vẫn chưa được xác định. Sau khi hấp thu, pepsin được lưu trữ trong các túi nội bào với pH thấp, nơi enzyme có thể phục hồi hoạt động. Pepsin có thể được lưu trữ trong tế bào đến 24 giờ. Sự tiếp xúc với pepsin ở pH trung tính và quá trình nhập bào có thể gây ra sự thay đổi trong biểu hiện gen liên quan đến viêm, làm nền tảng cho các dấu hiệu và triệu chứng của trào ngược, cũng như sự phát triển của khối u. Các nghiên cứu khác cũng liên quan đến pepsin trong ung thư do trào ngược dạ dày.
Pepsin trong mẫu vật đường thở được xem là dấu hiệu nhạy cảm và cụ thể cho trào ngược hầu thanh quản. Nghiên cứu hiện đang phát triển các công cụ chẩn đoán và điều trị pepsin để nhắm mục tiêu trào ngược dạ dày. Peptest, một công cụ chẩn đoán không xâm lấn, hiện đã có sẵn và có khả năng xác định sự hiện diện của pepsin trong mẫu nước bọt.
Bảo quản
Pepsin cần được bảo quản ở nhiệt độ cực thấp (từ -80°C đến -20°C) để ngăn chặn quá trình tự tiêu hóa (autolysis).
Các chất ức chế
Pepsin có thể bị ức chế bởi pH cao (xem 'hoạt động' và 'ổn định' ở trên) hoặc bởi các hợp chất ức chế. Pepstatin, một hợp chất có phân tử lượng thấp, là một chất ức chế mạnh đối với các protease acid với Ki khoảng 10M đối với pepsin. Dư lượng statyl của pepstatin được cho là nguyên nhân chính cho sự ức chế pepsin; statine là một analog tiềm năng của trạng thái chuyển tiếp cho xúc tác bởi pepsin và các protease acid khác. Pepstatin không liên kết đồng hóa trị với pepsin mà ức chế pepsin nhờ khả năng phá hủy. 1-bis (diazoacetyl) -2-penylethane ức chế pepsin ở pH 5, phản ứng này được tăng cường bởi sự hiện diện của Cu (II).
Pepsin cũng có thể bị ức chế qua cơ chế phản hồi; một sản phẩm của quá trình tiêu hóa protein làm giảm tốc độ phản ứng bằng cách ức chế pepsin.
Sucralfate cũng có khả năng ức chế hoạt động của pepsin.
Ứng dụng
Pepsin thương mại được chiết xuất từ lớp niêm mạc dạ dày heo và là một thành phần của rennet dùng để đông sữa trong sản xuất pho mát. Pepsin được ứng dụng rộng rãi trong ngành thực phẩm: để biến đổi và cải thiện chất lượng whipping của protein đậu nành và gelatin, biến đổi protein thực vật cho các sản phẩm ăn nhẹ không chứa bơ, xử lý ngũ cốc trước khi chế biến thành ngũ cốc nóng tức thời, và chuẩn bị thủy phân động vật và protein thực vật để dùng trong hương liệu thực phẩm và đồ uống. Trong ngành công nghiệp da, pepsin được sử dụng để loại bỏ lông và mô còn lại từ da, cũng như thu hồi bạc từ phim ảnh bằng cách tiêu hóa lớp gelatin chứa bạc. Pepsin còn được biết đến như một thành phần trong kẹo cao su Beemans của Tiến sĩ Edward E. Beeman và cũng là nguồn gốc của tên gọi Pepsi-Cola, ban đầu được sản xuất với pepsin và hạt côla.
Pepsin thường được sử dụng để chuẩn bị các mảnh F(ab')2 từ kháng thể. Trong một số nghiên cứu, chỉ phần Fab của kháng thể được sử dụng để liên kết với kháng nguyên. Để tạo ra mảnh F(ab')2, IgG được tiêu hóa bằng pepsin, cắt các chuỗi nặng gần khu vực bản lề. Các nhóm disulfide liên kết trong khu vực bản lề được bảo tồn, cho phép hai vùng Fab của kháng thể giữ liên kết với nhau, tạo ra phân tử hóa trị II (chứa hai vị trí liên kết kháng thể), tức là mảnh F(ab')2. Các chuỗi nhẹ vẫn còn nguyên và gắn với chuỗi nặng. Đoạn Fc bị phân hủy thành các peptide nhỏ. Mảnh Fab có thể được tạo ra bằng cách phân cắt IgG bằng papain thay vì pepsin. Papain cắt IgG tại khu vực bản lề, nơi các liên kết disulfide kết nối chuỗi nặng, nhưng dưới hoạt điểm của các liên kết disulfide giữa các chuỗi nhẹ và nặng, tạo ra các mảnh Fab và Fc còn nguyên vẹn. Các mảnh vỡ có thể được tinh chế bằng lọc gel, trao đổi ion, hoặc sắc ký ái lực.
Các mảnh Fab và F(ab')2 của kháng thể thường được sử dụng trong các hệ thống xét nghiệm để tránh ảnh hưởng của vùng Fc. Trong các mô như hạch bạch huyết hoặc lá lách, hoặc trong các chế phẩm máu ngoại vi, có sự hiện diện của các tế bào có thụ thể Fc (như đại thực bào, bạch cầu đơn nhân, tế bào lympho B, và tế bào giết tự nhiên) có thể liên kết với vùng Fc của kháng thể nguyên vẹn, gây nhiễu trong việc xác định kháng nguyên mục tiêu. Việc sử dụng F(ab')2 hoặc mảnh Fab đảm bảo kháng thể chỉ liên kết với kháng nguyên mà không bị thụ thể Fc can thiệp. Các mảnh vỡ này cũng hữu ích để nhuộm tế bào trong sự hiện diện của huyết tương, vì chúng không thể liên kết thêm và gây lyse các tế bào. F(ab')2, và đặc biệt là Fab, cho phép xác định chính xác các kháng nguyên mục tiêu, chẳng hạn như trong nhuộm mô cho kính hiển vi điện tử. Hóa trị của mảnh F(ab')2 cho phép liên kết chéo với kháng nguyên, phù hợp cho các xét nghiệm kết tủa, tập hợp tế bào thông qua kháng nguyên bề mặt, hoặc xét nghiệm rosetting.
Gen
Gen mã hóa enzyme pepsinogen có liên quan đến men pepsinogen nhân A:
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Một gen thứ tư mã hóa gastricsin, còn được gọi là pepsinogen C:
| ||||||||||||||||||||||
Sinh lý học ống tiêu hóa |
|---|
