1. Phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử là một loại phản ứng hóa học trong đó có sự chuyển giao electron giữa các chất, hoặc sự thay đổi số oxi hóa của các nguyên tố trong phản ứng.
- Chất khử (chất bị oxi hóa) là chất cho đi electron
- Quá trình oxi hóa (hay còn gọi là sự oxi hóa) là khi electron được nhường ra.
- Quá trình khử (hay còn gọi là sự khử) là khi electron được nhận vào.
2. Ví dụ về sự thay đổi số oxi hóa:


- Nguyên tử sắt hoạt động như một chất khử, và quá trình tăng số oxi hóa của sắt được gọi là sự oxi hóa của nguyên tử sắt.
- Nguyên tử sắt nhường electron, đóng vai trò chất khử, và hành động này được gọi là sự oxi hóa nguyên tử sắt.

- Khi số oxi hóa của đồng giảm từ +2 xuống 0, ion đồng trở thành chất oxi hóa. Quá trình này gọi là sự khử ion đồng.
- Ion đồng hoạt động như chất oxi hóa khi nhận electron, và hành động này được gọi là sự khử ion đồng.
⇒ Phản ứng giữa sắt và dung dịch đồng sunfat cũng là một phản ứng oxi hóa - khử, vì cả quá trình oxi hóa và khử đều xảy ra đồng thời.
3. Các phản ứng oxi hóa - khử
- Phản ứng oxi hóa - khử điển hình: phản ứng oxi hóa xảy ra ở hai chất khác nhau.
C + 4 HNO3 đặc → CO2 + 4 NO2 + 2 H2O
Cu + 2 H2SO4 đặc → CuSO4 + SO2 + 2 H2O
- Phản ứng oxi hóa - khử nội phân: đây là loại phản ứng trong đó các chất khử và oxi hóa nằm trong cùng một phân tử nhưng ở các nguyên tử khác nhau.
AgNO3 → Ag + NO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
- Phản ứng oxi hóa - khử tự nhiên: đây là phản ứng trong đó chất khử cũng đóng vai trò là chất oxi hóa.
Cl2 + 2 KOH → KCl + KClO + H2O
4 KClO3 → 3 KClO4 + KCl
4. Cân bằng phương trình hóa học cho phản ứng oxi hóa - khử
Bước 1: Xác định số oxi hóa của các nguyên tố để nhận diện chất oxi hóa và chất khử.
Bước 2: Viết các quá trình oxi hóa và khử, sau đó cân bằng từng quá trình.
Bước 3: Xác định hệ số phù hợp cho chất oxi hóa và chất khử để tổng số electron trao đổi bằng nhau.
Bước 4: Đặt hệ số cho các chất oxi hóa và khử vào sơ đồ phản ứng, từ đó tính toán hệ số cho các chất còn lại. Kiểm tra sự cân bằng số nguyên tử và cân bằng điện tích giữa hai vế để hoàn tất phương trình hóa học.
5. Ý nghĩa của phản ứng oxi hóa - khử
- Phản ứng oxi hóa - khử là một trong những quá trình thiết yếu nhất trong thiên nhiên.
Các quá trình như hô hấp, thực vật hấp thụ CO2 và giải phóng oxy, trao đổi chất, và nhiều quá trình sinh học khác đều dựa trên các phản ứng oxi hóa - khử.
- Thêm vào đó, việc đốt nhiên liệu trong động cơ, các quá trình điện phân, và phản ứng trong pin và ắc quy đều liên quan đến sự oxi hóa và khử.
Nhiều quy trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học,... sẽ không thể thực hiện được nếu không có các phản ứng oxi hóa - khử.
6. Bài tập ứng dụng
- Định luật bảo toàn electron
Trong phản ứng oxi hóa - khử, số mol electron mà chất khử nhường phải bằng số mol electron mà chất oxi hóa nhận.
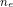
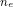
Áp dụng đặc tính này để thiết lập các phương trình liên hệ và giải bài tập theo phương pháp bảo toàn electron.
- Nguyên tắc
Tạo hai sơ đồ: Một sơ đồ cho chất khử nhường electron và một sơ đồ cho chất oxi hóa nhận electron.
- Một số lưu ý
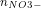
a, Bài toán liên quan đến kim loại phản ứng với axit không có tính oxi hóa
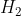
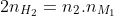
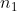
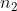
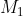
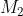
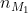

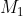
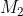
Công thức để tính khối lượng muối trong dung dịch là:
Khối lượng muối (m) = Khối lượng kim loại (m) + Khối lượng gốc axit (m)
Số mol của gốc axit được tính bằng công thức:
N (gốc axit) = Tổng số electron trao đổi / Điện tích của gốc axit
- Đối với H2SO4: khối lượng muối (m) = khối lượng kim loại (m) + 96 × n (H2)
- Đối với HCl: khối lượng muối (m) = khối lượng kim loại (m) + 71 × n (H2)
- Đối với HBr: khối lượng muối (m) = khối lượng kim loại (m) + 160 × n (H2)
b, Bài toán về kim loại phản ứng với axit có tính oxi hóa
Trong các phản ứng oxy hóa-khử, sản phẩm thường chứa các muối như muối sunfat SO4 (2-) với điện tích -2, muối nitrat NO3 (-) với điện tích -1, muối halogen X (-) với điện tích -1. Thành phần muối bao gồm các cation kim loại (hoặc caion NH4+) và anion gốc axit. Để tính khối lượng muối trong dung dịch, ta thực hiện như sau:
Khối lượng muối (m) = Khối lượng kim loại (m) + khối lượng phân tử gốc axit (mm)
Trong đó: khối lượng gốc axit (m) = khối lượng mol của gốc axit (M) × số điện tích của gốc axit (ne)
* Lưu ý:
- Đối với kim loại có nhiều mức số oxy hóa, khi phản ứng với dung dịch HNO3 loãng hoặc HNO3 đặc nóng, sẽ đạt mức số oxy hóa cao nhất.
- Hầu hết các kim loại có thể phản ứng với HNO3 đặc nóng (trừ Pt, Au) và với HNO3 đặc nguội (trừ Pt, Au, Fe, Al, Cr,...) khi đó N (5+) trong HNO3 sẽ bị khử xuống mức oxy hóa thấp hơn trong các đơn chất tương ứng.
- Các kim loại khi tác dụng với ion trong môi trường axit H(+) được coi như phản ứng với HNO3. Các kim loại như Zn, Al phản ứng với ion trong môi trường kiềm OH(-) sẽ giải phóng NH3.
7. Ví dụ minh họa
Ví dụ 1: Khi hòa tan 7,8 g hỗn hợp Al và Mg vào dung dịch HCl dư, khối lượng dung dịch axit tăng thêm 7,0 g. Xác định khối lượng Al và Mg trong hỗn hợp ban đầu.
Hướng dẫn giải:
Sử dụng định luật bảo toàn khối lượng, ta có:

Ngoài ra:


2 H + 2 e → H2
Theo bài toán, ta có hệ phương trình sau:
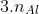
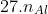
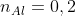
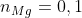
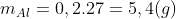
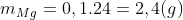
Ví dụ 2: Khi hòa tan 15 g hỗn hợp X chứa Mg và Al vào dung dịch Y bao gồm HNO3 và H2SO4 đặc, thu được 0,1 mol các khí SO2, NO2, NO, N2O. Tính phần trăm khối lượng của Al và Mg trong hỗn hợp X.
Hướng dẫn giải:
Ta có:
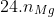
Xem xét quá trình oxi hóa:


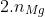
Xem xét quá trình khử:
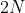
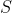
Tổng số mol electron nhận được là 2 . 0,4 + 0,2 = 1,4 mol
Theo định luật bảo toàn electron, ta có:
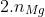
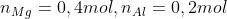
⇒ % Al = 27 . 0,2 / 15 = 36 %
% Mg = 100 % - 36 % = 64 %
Ví dụ 3: Khi 6,3 g hỗn hợp Mg và Zn phản ứng hoàn toàn với dung dịch HCl, thu được 3,36 lít H2 ở điều kiện tiêu chuẩn. Tính khối lượng muối tạo thành trong dung dịch.
Hướng dẫn giải:

0,3 0,15
Do đó, khối lượng muối trong dung dịch là:
m (muối) = m (kim loại) + m (gốc axit) = 6,3 + 35,5 . 0,3 / 1 = 16,95 g
Trên đây là bài viết của Mytour về phản ứng oxi hóa khử và các khía cạnh liên quan. Hy vọng bài viết sẽ hữu ích cho bạn đọc. Xin cảm ơn!
