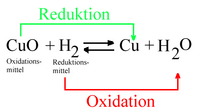
Phản ứng oxy hóa khử còn được gọi là oxy hóa hoàn nguyên trong hóa học hữu cơ (không nên viết là oxi hóa vì có thể làm người đọc nhầm lẫn với các quá trình khác sử dụng oxy). Đây là một loại phản ứng hóa học mà các tác chất trải qua thay đổi về trạng thái oxy hóa hoặc số oxy hóa. Sự oxy hóa là quá trình chuyển nhượng, trao đổi, hay mất đi electron (điện tử) hoặc làm tăng số oxi hóa. Ngược lại, sự khử là quá trình nhận electron hoặc làm giảm số oxy hóa.
Phản ứng oxy hóa khử được phân thành hai nhóm chính:
- Sự chuyển động của electron: Thường chỉ có một electron di chuyển từ một phân tử, ion hoặc nguyên tử bị oxy hóa đến một phân tử, ion hoặc nguyên tử bị khôi phục. Loại phản ứng này thường được nhắc đến khi nói về sự oxy hóa khử của một cặp hợp chất hoặc trong hóa học điện hóa.
- Sự chuyển động của phân tử: Một phân tử di chuyển từ tác chất này sang tác chất khác. Ví dụ, khi sắt bị rỉ sét, trạng thái oxy hóa của các phân tử sắt tăng lên khi sắt chuyển hóa thành sắt oxit, đồng thời trạng thái oxy hóa của oxy giảm khi nhận được electron từ phân tử sắt. Mặc dù phản ứng oxy hóa thường đi kèm với việc tạo ra oxy hóa (như oxit sắt (II)), phản ứng này vẫn có thể xảy ra với các chất phụ khác. Trong phản ứng hydrogen hóa, các liên kết C=C bị khôi phục hoặc khôi phục bởi sự chuyển động của phân tử hydrogen.
Số oxi hóa
Số oxi hóa hay trạng thái oxi hóa (oxidation state) là chỉ số điện tích hình thức của một phân tử trong một nguyên tử (hoặc một ion).
Chất oxi hóa
Chất oxi hóa là chất lấy đi electron từ chất khác, từ đó chính nó bị khử. Vì khả năng nhận electron, chất oxi hóa còn được gọi là chất nhận electron (electron acceptor). Các chất oxi hóa mạnh thường là các hợp chất có nguyên tố ở trạng thái oxi hóa cao nhất, ví dụ như MnO
4, CrO3, Cr
2O
7, OsO4, HNO3, CuO, ... hoặc là các nguyên tố có độ âm điện cao như O2, F2, Cl2, Br2, ... có khả năng nhận electron bằng cách oxi hóa các chất khác.
Ban đầu, sự oxi hóa được áp dụng cho các phản ứng có sự hiện diện của oxy hình thành một oxit. Sau này, thuật ngữ này đã được mở rộng để bao gồm cả các hợp chất thực hiện phản ứng hóa học tương tự như với oxy. Ngày nay, thuật ngữ này được sử dụng rộng rãi cho các phản ứng mà có sự nhường electron hoặc tăng số oxi hóa của các tiểu phân. Một chất có khả năng oxi hóa một chất khác (làm cho chúng mất đi electron) được coi là chất oxi hóa, hay còn gọi là tác nhân oxi hóa.
Chất khử
Các chất có khả năng nhường electron cho các chất khác được gọi là chất khử, tác nhân khử, hoặc tác nhân hoàn nguyên. Chúng nhường electron cho một chất khác, do đó bản thân chúng bị oxid hóa. Vì khả năng nhường electron, chúng còn được gọi là chất nhường electron (electron donor). Chất khử trong hóa học rất đa dạng. Các kim loại như lithium, sodium, magnesium, sắt, kẽm, nhôm, có độ âm điện dương cao, là các chất khử tốt. Những kim loại này có thể nhường electron một cách tương đối dễ dàng.
Trong hóa học hữu cơ, các tác nhân như NaBH4, LiAlH4 có khả năng chuyển giao hydride, làm giảm carbonyl thành alcohol trong các phản ứng hoàn nguyên. Một ví dụ khác là phản ứng hoàn nguyên bằng khí hydrogen với xúc tác, trong đó các phân tử hydrogen chuyển giao electron.
Thuật ngữ 'sự khử' ban đầu được sử dụng để mô tả quá trình giảm khối lượng khi nung nóng quặng kim loại chứa oxit kim loại để thu được kim loại nguyên chất. Nói cách khác, quặng bị khử thành kim loại. Antoine Lavoisier đã chỉ ra rằng sự giảm khối lượng xảy ra do mất đi oxygen dưới dạng khí. Sau đó, các nhà khoa học nhận ra rằng các phân tử kim loại đã nhận electron trong quá trình này. Sau này, thuật ngữ 'sự khử' đã được mở rộng để bao gồm các quá trình mà các chất nhận electron.
Chất khử mạnh thường là các hợp chất có các nguyên tố ở trạng thái oxi hóa thấp nhất, như NH3, H2S, CO, S
2O
3, NaH, ... hoặc là các nguyên tố có độ âm điện thấp như H2, C, kim loại kiềm (Na, K, ...) hay kim loại kiềm thổ (Ca, Mg, ...), ...
Phân loại các phản ứng oxi hóa khử
Các phản ứng oxi hóa khử có thể được phân loại thành các loại phản ứng con sau đây:
- Phản ứng tổng hợp
- Phản ứng phân hủy
- Phản ứng đốt cháy
- Phản ứng thế (thế hiđro, thế kim loại, thế halogen)
- Phản ứng giải thể
Cần lưu ý rằng không phải tất cả các phản ứng tổng hợp hoặc phân hủy đều là phản ứng oxi hóa khử.
Liên kết bên ngoài
- Phản ứng oxi hóa khử (phản ứng hóa học) tại Encyclopædia Britannica (tiếng Anh)

Các dạng và quá trình phong hóa | ||
|---|---|---|
| Phong hóa hóa học |
| |
| Phong hóa vật lý |
| |
| Chủ đề liên quan |
| |
Thể loại * Hình ảnh | ||
| Tiêu đề chuẩn |
|
|---|
