1. Phương trình phản ứng hóa học của NaOH với Ba(HCO3)2
Phản ứng giữa NaOH (hydroxide natri) và Ba(HCO₃)₂ (barium hydrogen carbonate) được thể hiện qua phương trình hóa học sau:
Ba(HCO3)2 + 2NaOH → Ba(OH)2 + 2NaHCO3
Khi natri hydroxide (NaOH) phản ứng với barium hydrogen carbonate (Ba(HCO₃)₂), kết quả là sự hình thành barium hydroxide (Ba(OH)₂) và natri hydrogen carbonate (NaHCO₃).
2. Điều kiện cần để phản ứng giữa Ba(HCO3)2 và NaOH xảy ra
Nhiệt độ phòng, khoảng 25°C, thường đủ để kích hoạt phản ứng này.
3. Hiện tượng quan sát được khi NaOH phản ứng với Ba(HCO3)2
Trong phản ứng giữa NaOH (natri hydroxide) và Ba(HCO₃)₂ (barium hydrogen carbonate), ta sẽ thấy một số hiện tượng đặc trưng. Xuất hiện kết tủa, chủ yếu là Ba(OH)₂, làm cho dung dịch có thể trở nên đục. Đồng thời, khí CO₂ (carbon dioxide) có thể thoát ra, làm tăng nhiệt độ của dung dịch do phản ứng sinh nhiệt.
Phản ứng giữa NaOH và Ba(HCO₃)₂ tạo ra nhiều hiện tượng thú vị như kết tủa, khí thoát ra, và thay đổi nhiệt độ, khiến quá trình phản ứng trở nên rõ ràng và dễ theo dõi trong thực tế.
4. Phương trình ion rút gọn của phản ứng giữa NaOH và Ba(HCO3)
Bước 1: Phương trình phân tử là:
2NaOH + Ba(HCO3) → Na2CO3 + BaCO3 ↓ + H2O
Bước 2: Chuyển các chất thành ion
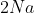
Tại đây:
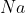
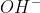 322+
322+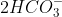
Bước 3: Loại bỏ các ion giống nhau ở cả hai phía:
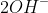 -
-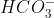
Phương trình ion rút gọn của phản ứng giữa NaOH và Ba(HCO3)2 là:
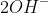
Phương trình này tập trung vào các ion quan trọng để thể hiện quá trình ion hóa và sự kết tủa trong phản ứng.
5. Kiến thức cơ bản về NaOH
Natri hydroxide (NaOH) là một chất rắn không màu với tính chất vật lý đặc trưng. NaOH có khả năng hút ẩm mạnh mẽ, khiến nó dễ chảy và hòa tan trong không khí ẩm. Chất này cũng dễ nóng chảy và khi hòa tan trong nước, NaOH giải phóng một lượng nhiệt lớn, vì vậy cần cẩn thận khi xử lý. Phản ứng giữa NaOH và Ba(HCO₃)₂ được biểu diễn bằng phương trình sau:
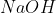
Trong môi trường nước, NaOH hoàn toàn phân li thành các ion Na+ và OH-. Điều này khiến NaOH trở thành một bazơ mạnh, thể hiện qua việc chuyển quỳ tím sang màu xanh và làm cho phenolphthalein chuyển từ không màu sang màu hồng. Khi phản ứng với axit như HCl, NaOH tạo ra muối (ví dụ: NaCl) và nước.
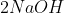
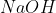
Các ứng dụng:
NaOH, hay natri hydroxide, không chỉ là một hợp chất hóa học quan trọng mà còn đóng vai trò thiết yếu trong nhiều lĩnh vực sản xuất và công nghiệp khác nhau.
Trong ngành sản xuất xà phòng, NaOH được dùng để chế tạo xà phòng từ axit béo, một quá trình hóa học truyền thống nhưng vẫn còn phổ biến trong ngành công nghiệp này.
NaOH cũng đóng vai trò quan trọng trong ngành chế phẩm nhuộm. Trong quá trình nhuộm, NaOH thường được sử dụng để điều chỉnh pH của dung dịch, tạo điều kiện tối ưu cho quá trình nhuộm.
Trong ngành sản xuất tơ nhân tạo, NaOH được sử dụng để xử lý sợi cellulose từ cây bông, biến chúng thành tơ nhân tạo như rayon. Quy trình này được gọi là xử lý cellulose tinh khiết.
Ở quy mô lớn, NaOH còn tham gia vào quá trình luyện kim loại như nhôm. Trong ngành công nghiệp luyện nhôm, quặng nhôm thô thường chứa các oxit và hydroxide, và NaOH được dùng để loại bỏ những tạp chất này, giúp tạo ra nhôm có chất lượng cao hơn.
Ngoài ra, NaOH cũng đóng vai trò trong ngành công nghiệp chế biến dầu mỏ. Nó được sử dụng trong quá trình hydrocracking để chuyển đổi các hydrocarbon chưa no thành dạng no, qua đó nâng cao chất lượng nhiên liệu dầu.
Tóm lại, NaOH không chỉ là một chất hóa học với tính kiềm mạnh mà còn là một thành phần thiết yếu trong nhiều ngành công nghiệp, từ sản xuất hóa mỹ phẩm đến chế tạo tơ nhân tạo và luyện kim loại.
6 Bài tập ứng dụng
Câu 1: Khi đưa kim loại Na vào dung dịch CuSO4, hiện tượng gì sẽ xảy ra?
A. Ban đầu xuất hiện kết tủa màu xanh, sau đó kết tủa tan ra và dung dịch trở nên trong suốt.
B. Ban đầu có sự sủi bọt khí, rồi sau đó kết tủa màu xanh xuất hiện.
C. Ban đầu có sự sủi bọt khí, tiếp theo là sự hình thành kết tủa xanh, rồi kết tủa tan ra và dung dịch trở nên trong suốt.
D. Chỉ có hiện tượng sủi bọt khí.
Đáp án chính xác là: C. Ban đầu xuất hiện sự sủi bọt khí, sau đó kết tủa màu xanh hình thành, và cuối cùng kết tủa tan ra, dung dịch trở nên trong suốt.
Giải thích:
Khi kim loại natri (Na) được cho vào dung dịch đồng sulfat (CuSO₄), một phản ứng oxi hóa khử xảy ra. Natri (Na) có khả năng thay thế đồng (Cu) trong dung dịch và tạo thành natri sulfat (Na₂SO₄). Phản ứng hóa học này được thể hiện như sau:
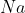
Phản ứng này dẫn đến việc sủi bọt khí hydrogen (H₂) do natri phản ứng với nước trong dung dịch. Đồng thời, kết tủa đồng màu đỏ (Cu) xuất hiện nhưng sau đó sẽ tan ra khi natri sulfat được hình thành.
Vì vậy, hiện tượng sủi bọt khí đầu tiên, sau đó hình thành kết tủa xanh và cuối cùng kết tủa tan ra, là mô tả chính xác cho phản ứng giữa kim loại Na và dung dịch CuSO₄.
Câu 2: Dãy các chất nào đều phản ứng với dung dịch Ba(HCO3)2?
A. HNO3, NaCl và Na2SO4
B. HNO3, Ca(OH)2 và KNO3
C. NaCl, Na2SO4 và Ca(OH)2
D. HNO3, Ca(OH)2 và Na2SO4
Đáp án chính xác là: A. HNO3, NaCl và Na2SO4
Giải thích:
Dung dịch Ba(HCO3)2 là dung dịch muối barium hydrogen carbonate. Các chất HNO3 (axit nitric), NaCl (muối natri clorua), và Na2SO4 (muối natri sunfat) đều có thể phản ứng với dung dịch Ba(HCO3)2 theo các phương trình phản ứng phù hợp.
Các phản ứng có thể xảy ra như sau:
HNO3: Ba(HCO3)2 + 2HNO3 → Ba(NO3)2 + 2H2O + 2CO2↑
NaCl: Ba(HCO3)2 + 2NaCl → BaCl2 + 2NaHCO3
Na2SO4: Ba(HCO3)2 + Na2SO4 → BaSO4↓ + 2NaHCO3
Do đó, các chất HNO3, NaCl và Na2SO4 đều có khả năng phản ứng với dung dịch Ba(HCO3)2, và đáp án A là đúng.
Câu 3: Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành hình thuyền. Sau đó, đặt chiếc thuyền giấy này vào một chậu nước có thêm vài giọt phenolphtalein. Dự đoán hiện tượng có thể quan sát được trong thí nghiệm này:
(a) Chiếc thuyền di chuyển quanh chậu nước.
(b) Chiếc thuyền bị cháy.
(c) Nước chuyển thành màu hồng.
(d) Mẩu natri bị nóng chảy.
Trong các dự đoán trên, số dự đoán chính xác là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là A
Dự đoán chính xác là: (c) Nước chuyển màu hồng.
Giải thích: Khi chiếc thuyền giấy làm từ natri tiếp xúc với nước, xảy ra phản ứng sau:
2Na + 2H2O → 2NaOH + H2 ↑
Natri phản ứng với nước tạo ra natri hydroxide (NaOH) và khí hydrogen (H₂). Phenolphtalein là chất chỉ thị pH, chuyển từ không màu sang màu hồng trong môi trường kiềm (pH cao).
Do đó, nếu nước chuyển màu hồng, có nghĩa là phenolphtalein đã phát hiện sự hiện diện của natri hydroxide (NaOH) trong nước, chứng minh phản ứng giữa natri và nước đã xảy ra, tạo thành dung dịch bazơ (NaOH) và khí hydrogen. Các dự đoán khác không phản ánh đúng hiện tượng thực tế trong thí nghiệm này.
Câu 4: Trung hòa V ml dung dịch NaOH 1M bằng 100 ml dung dịch HCl 1M. Tính giá trị của V.
A. 400.
B. 200.
C. 100.
D. 300.
Đáp án và giải thích chi tiết:
Để tìm giá trị của V, chúng ta áp dụng nguyên tắc trung hòa trong phản ứng giữa axit và bazơ: số mol của axit sẽ bằng số mol của bazơ.
Số mol của axit = Số mol của bazơ
Trong trường hợp này, số mol của HCl (axit) sẽ bằng số mol của NaOH (bazơ) sau khi phản ứng hoàn tất.
Số mol của HCl = c × V1, với c là nồng độ của axit (1M) và V1 là thể tích của axit (100 ml).
Số mol của bazơ NaOH = c × V2, trong đó V2 là thể tích của bazơ (V ml).
c × V1 = c × V2
1 × 100 = 1 × V
V = 100
Vì vậy, giá trị của V là 100 ml.
Kết quả đúng là: C. 100.
