1. Phương trình phản ứng hóa học của AgCl sinh ra Cl2
2AgCl → 2Ag + Cl2
Trong phản ứng này, AgCl (klorua bạc) phân hủy thành bạc (Ag) và khí clo (Cl2) khi tiếp xúc với ánh sáng hoặc nguồn năng lượng khác. Đây là một phản ứng phân hủy quang học, trong đó klorua bạc giải phóng khí clo.
2. Điều kiện để phản ứng AgCl chuyển thành Ag
Phản ứng hóa học 2AgCl → 2Ag + Cl2 là một phản ứng phân hủy quang học, nghĩa là nó diễn ra dưới ánh sáng. Dưới đây là các điều kiện và hiện tượng chi tiết của phản ứng:
Điều kiện thực hiện phản ứng:
- Nhiệt độ: Ở nhiệt độ phòng, khoảng 25°C.
- Ánh sáng: Phản ứng này cần ánh sáng để kích thích quá trình phân hủy. Năng lượng từ ánh sáng làm yếu liên kết trong AgCl và dẫn đến sự hình thành các sản phẩm phân hủy.
Hiện tượng quan sát được:
- Khi AgCl được chiếu sáng, nó sẽ phân hủy thành Ag và Cl2.
- Cl2 là khí clo, có màu vàng nhạt. Màu vàng này xuất hiện do sự tạo thành khí clo (Cl2) trong pha khí.
- Khí Cl2 có khả năng làm đỏ giấy quỳ tím, chứng minh tính axit của khí clo. Phản ứng xảy ra như sau:
Cl2 + 2OH- → Cl- + OCl- + H2O
Trong phản ứng này, khí Cl2 tương tác với ion hydroxide (OH-) để tạo ra các ion Cl- và OCl-, làm cho môi trường trở nên axit.
Tóm lại, phản ứng 2AgCl → 2Ag + Cl2 diễn ra dưới ánh sáng, giải phóng khí clo màu vàng nhạt và có khả năng làm đỏ giấy quỳ tím, cho thấy tính axit của khí clo tạo ra.
3. Tính chất hóa học của khí Clo
3.1. Phản ứng với kim loại
Khí clo phản ứng với hầu hết các kim loại, tạo thành muối clorua.
2Na + Cl2 → 2NaCl
2Fe + 3Cl2 → 2FeCl3
Chú ý: Phản ứng này diễn ra ở nhiệt độ phòng hoặc không quá cao, xảy ra nhanh và tỏa nhiều nhiệt.
3.2. Phản ứng với hiđro
Tại nhiệt độ phòng, khí clo không phản ứng với hiđro.
Khi hỗn hợp được chiếu sáng bằng ánh sáng mặt trời hoặc ánh sáng từ magie cháy, phản ứng xảy ra nhanh chóng và có thể gây nổ mạnh nhất khi tỷ lệ mol là 1:1.
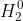
3.3. Phản ứng với nước
Khi một phần khí Clo phản ứng với nước, sẽ tạo ra hỗn hợp axit clohiđric và axit hipocloro. Hỗn hợp này có tính tẩy màu mạnh nhờ H+1ClO, một chất oxy hóa rất mạnh.
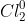
⇒ Khi Clo hòa tan trong nước, sẽ xảy ra cả hiện tượng vật lý lẫn hiện tượng hóa học.
3.4. Phản ứng với dung dịch kiềm
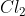
. Phản ứng với một số hợp chất khử
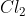
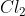
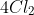
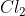
Nhận xét: Trong các phản ứng với H2, kim loại và chất khử, Clo đóng vai trò là chất oxy hóa. Khi phản ứng với H2O và dung dịch kiềm, Clo vừa là chất oxy hóa vừa là chất khử.
4. Một số bài tập ứng dụng
Câu 1. Trong phòng thí nghiệm, Clo thường được điều chế bằng cách nào sau đây:
A. Đưa dung dịch HCl đặc vào MnO2 và đun nóng.
B. Sử dụng F2 để đẩy Cl2 ra khỏi dung dịch NaCl.
C. Điện phân NaCl nóng chảy.
D. Điện phân dung dịch NaCl có màng ngăn.
Đáp án và giải thích
Đáp án chính xác là: C. Điện phân NaCl nóng chảy.
Giải thích: Trong phòng thí nghiệm, Clo được điều chế chủ yếu bằng phương pháp điện phân NaCl nóng chảy. Quá trình này được thực hiện trong một cell điện phân, nơi NaCl được nung chảy thành dung dịch muối lỏng. Sau đó, điện áp được áp dụng để phân ly muối thành Clo (2Cl2) và kim loại sodium (Na).
Phương trình phản ứng chính là:
2NaCl(l) → 2Na(l) + Cl2 (g)
Điện phân NaCl nóng chảy không chỉ sản xuất Clo mà còn tạo ra kim loại sodium. Clo được thu gom và sử dụng trong quá trình này, giúp sản xuất Clo từ muối NaCl một cách hiệu quả.
Câu 2. Dưới đây là các nhận xét về Clo và các hợp chất của nó:
1) Nước javel có khả năng tẩy màu và diệt khuẩn.
2) Khi cho giấy quì tím vào dung dịch nước clo, giấy quì tím sẽ chuyển màu hồng và sau đó mất màu.
3) Trong phản ứng giữa HCl và MnO2, HCl đóng vai trò là chất bị oxi hóa.
4) Cl2 được sản xuất qua quá trình điện phân dung dịch NaCl, sử dụng màng ngăn và điện cực trơ.
Trong số các nhận xét dưới đây, số lượng nhận xét chính xác là:
A. 2.
B. 3.
C. 4.
D. 1.
Đáp án và giải thích:
Trong các nhận xét trước, đáp án đúng là: D. 1.
Giải thích:
Nhận xét 1: Nước zaven (nước clo) có khả năng tẩy trắng và diệt khuẩn. Nước clo thường được dùng làm chất tẩy trắng hiệu quả và có tính kháng khuẩn.
Nhận xét 2: Khi cho giấy quì tím vào dung dịch nước clo, quì tím sẽ chuyển sang màu hồng do tính axit của nước clo. Tuy nhiên, màu hồng này sẽ mất đi vì clo có khả năng oxi hóa giấy quì tím.
Nhận xét 3: Trong phản ứng giữa HCl và MnO2, HCl là chất bị khử. MnO2 sẽ bị khử còn HCl sẽ bị oxi hóa.
Nhận xét 4: Cl2 được sản xuất bằng cách điện phân dung dịch NaCl sử dụng màng ngăn và điện cực trơ.
Câu 3. Nhận định nào sau đây là chính xác nhất về muối:
A. Muối là hợp chất có khả năng phản ứng với bazơ.
B. Muối là một hợp chất vẫn chứa hiđro trong cấu trúc phân tử của nó.
C. Một hợp chất khi hòa tan trong nước sẽ phân ly thành cation kim loại (hoặc cation NH4+) và anion axit.
D. Muối là hợp chất có chứa hiđro có khả năng phân ly thành cation.
Đáp án và giải thích:
Câu trả lời chính xác là: C. Một hợp chất khi hòa tan trong nước phân ly thành cation kim loại (hoặc cation NH4+) và anion axit.
Giải thích: Muối là hợp chất hình thành từ phản ứng giữa axit và bazơ. Khi muối hòa tan trong nước, nó phân ly thành các ion dương và âm. Trong trường hợp muối hình thành từ axit và bazơ, các ion dương có thể là kim loại hoặc NH4+, và các ion âm là gốc axit.
+−+
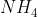
Câu 4. Trong các dãy chất dưới đây, dãy nào sẽ phân hủy khi đun nóng ở nhiệt độ cao?
A. CaCO3, Zn(OH)2, AgCl, KMNO4
B. BaSO3, BaCl2, KOH, Na2SO4
C. AgNO3, Na2CO3, KCI, BaSO4
D. Fe(OH)3, Na2SO4, BaSO4, KCl
Chi tiết đáp án và giải thích:
Câu trả lời chính xác là: A. CaCO3, Zn(OH)2, AgCl, KMnO4
Giải thích cụ thể:
CaCO3 (canxi cacbonat) sẽ bị phân hủy nhiệt thành CaO (canxi oxit) và CO2 (cacbon dioxide).
Zn(OH)2 (kẽm hydroxit) bị phân hủy nhiệt thành ZnO (kẽm oxit) và H2O (nước).
AgCl (bạc clorua) không bị phân hủy nhiệt ở nhiệt độ cao.
KMnO4 (kali permanganat) phân hủy thành các sản phẩm khác nhau tùy thuộc vào điều kiện, nhưng có thể phân hủy ở nhiệt độ cao.
Các chất trong các lựa chọn B, C, D đều không bị phân hủy nhiệt ở nhiệt độ cao, ngoại trừ KMnO4 trong lựa chọn A.
Câu 5. Khi cho clo vào nước, thu được nước clo. Biết rằng clo phản ứng không hoàn toàn với nước, nước clo là hỗn hợp của các chất:
A. HCl, HClO
B. HClO, Cl2, H2O
C. H2O, HCl, HClO
D. H2O, HCl, HClO, Cl2
Đáp án và giải thích chi tiết:
Đáp án chính xác là: C. H2O, HCl, HClO
Giải thích: Khi khí clo (Cl2) được hòa vào nước (H2O), nó phản ứng để tạo ra nước clo (HOCl, axit hypochlorous) và axit clohydric (HCl).
Cl2 + H2O ⇌ HCl + HClO
Nước clo là hỗn hợp của H2O, HCl, và HClO, và các chất này có thể đạt trạng thái cân bằng hóa học trong nước clo.
Câu 6: Khi đưa ống nghiệm chứa AgCl ra ánh sáng và nhỏ thêm vài giọt dung dịch quỳ tím, hiện tượng quan sát được là
A. Không quan sát được hiện tượng nào.
B. Quỳ tím chuyển sang đỏ rồi sau đó bị mất màu.
C. Chất rắn chuyển thành màu đen.
D. Chất rắn đổi sang màu đen và quỳ tím biến thành màu đỏ rồi mất màu.
Đáp án đúng là: C. Chất rắn chuyển thành màu đen.
Giải thích: Khi ống nghiệm chứa AgCl được đặt dưới ánh sáng, AgCl sẽ bị phân hủy thành Ag (bạc) và Cl2 (khí clo) do tác động của ánh sáng.
2AgCl → 2Ag + Cl2
Chất rắn Ag hình thành có màu đen, cho thấy sự hiện diện của Ag trong ống nghiệm.
Quỳ tím có thể không thay đổi màu khi thêm vào ống nghiệm vì sự thay đổi pH không đủ lớn để làm biến đổi màu của quỳ tím trong quá trình phản ứng.
