
Một pin Li-ion (dùng cho ô tô điện VinFast VF 8) | |
| Năng lượng riêng | 100–265 W·h/kg (0.36–0.875 MJ/kg) |
|---|---|
| Mật độ năng lượng | 250–693 W·h/L (0.90–2.43 MJ/L) |
| Công suất riêng | ~250-~340 W/kg |
| Hiệu suất sạc/xả sạc | 80–90% |
| Năng lượng/giá bán | 2.5 W·h/US$ |
| Suất tự xả | 8% at 21 °C 15% at 40 °C 31% at 60 °C (per month) |
| Số lần sạc ước tính | 400–1200 cycles |
| Điện áp danh nghĩa | NMC 3.6 / 3.85 V, LiFePO4 3.2 V |
Pin lithium-ion hay pin lithi-ion / pin lithium-ion, có khi viết tắt là LIB, là một loại pin sạc. Trong quá trình sạc, các ion Lithi chuyển động từ cực dương sang cực âm, và ngược lại trong quá trình xả (quá trình sử dụng). LIB thường sử dụng điện cực là các hợp chất mà cấu trúc tinh thể của chúng có dạng lớp (layered structure compounds), khi đó trong quá trình sạc và xả, các ion lithi sẽ xâm nhập và điền đầy khoảng trống giữa các lớp này, nhờ đó phản ứng hóa học xảy ra. Các vật liệu điện cực có cấu trúc tinh thể dạng lớp thường gặp dùng cho cực âm là các hợp chất oxide kim loại chuyển tiếp như LiCoO2, LiMnO2, v.v….; dùng cho điện cực dương là graphite. Dung dịch điện ly của pin cho phép các ion lithi chuyển dịch từ cực này sang cực khác, nghĩa là có khả năng dẫn ion lithi. Tuy nhiên, yêu cầu là dung dịch này không được dẫn điện.
LIB thường được dùng cho những thiết bị điện di động, phổ biến nhất là pin sạc cho các thiết bị điện tử cầm tay. Pin lithium-ion có mật độ năng lượng cao, hiệu ứng nhớ rất nhỏ, và ít bị tự xả. Hiện nay ở các nước phát triển, LIB đang được chú trọng phát triển trong quân đội, ứng dụng cho các phương tiện di chuyển chạy điện và kĩ thuật hàng không. Nó được kì vọng sẽ thay thế cho ắc quy chì trong ô tô, xe máy và các loại xe điện. Hơn nữa, việc thay thế cho ắc quy chì còn hứa hẹn việc đảm bảo môi trường sạch, nâng cao an toàn sử dụng do tránh được việc sử dụng dung dịch điện ly chứa acid, và hạn chế phát thải kim loại nặng ra môi trường, trong khi pin lithium-ion vẫn đảm bảo một điện thế ngang với ắc quy.
Thành phần hóa học, hiệu năng, giá thành và độ an toàn là các yếu tố cơ bản quy định các loại LIB khác nhau. Các thiết bị điện cầm tay (như điện thoại di động, laptop) hiện nay hầu như sử dụng LiCoO2 (viết tắt LCO) lithium cobalt oxide làm cực âm. Chất này có mật độ năng lượng cao, nhưng kém an toàn, đặc biệt nguy hiểm khi pin bị rò rỉ. Lithium sắt phosphat (LiFePO4, hay LFP), lithi mangan oxide (LiMn2O4, Li2MnO3, hay gọi chung là LMO) và lithi nickel mangan cobalt oxide (LiNiMnCoO2, hay NMC) là các vật liệu dương cực phổ biển khác, tuy nhiên chúng có mật độ năng lượng thấp hơn LCO, nhưng lại có vòng đời lâu hơn và an toàn hơn. Những pin dùng các vật liệu này thường được dùng trong các thiết bị điện y tế. Đặc biệt NMC hiện nay là ứng viên hàng đầu cho pin ứng dụng trong xe chạy điện. Lithium nickel cobalt nhôm oxide (LiNiCoAlO2 hay NCA) và lithi titanat (Li4Ti5O12 hay LTO) được sử dụng trong những mục đích đặc biệt. Pin lithium-sulfide hay pin lithi-sulfide là loại pin mới được phát triển, mang nhiều triển vọng nhờ hiệu năng cao và khối lượng nhỏ.
Do pin lithium-ion chứa dung dịch điện ly dễ cháy, nên nó trở nên đặc biệt nguy hiểm khi áp suất bên trong cell pin tăng cao khi được sạc và xả với cường độ dòng điện lớn. Nếu như một viên pin được sạc quá nhanh, nó có thể gây đoản mạch dẫn đến cháy nổ. Do nguy cơ này, các quy chuẩn kiểm tra dành cho pin lithium-ion (LIB) nghiêm ngặt hơn rất nhiều so với các loại pin dung dịch điện ly acid. Một ví dụ nổi tiếng về vấn đề này là sự cố về pin của Samsung Galaxy Note 7 vào năm 2016.
Các lĩnh vực nghiên cứu về pin lithium-ion bao gồm kéo dài vòng đời pin, tăng mật độ năng lượng, nâng cao an toàn và giảm chi phí sản xuất.
Lịch sử
Phát minh và phát triển

Pin Lithium được phát minh bởi nhà hóa học người Anh M. Stanley Whittingham, hiện đang giảng dạy tại Đại học Binghamton, khi làm việc cho Exxon vào những năm 1970. Ông đã sử dụng titan (IV) sulfide và kim loại lithium làm điện cực. Tuy nhiên, pin lithium sạc này không thể được đưa vào thực tế. Titan disulfide là một lựa chọn không tốt, vì nó phải được tổng hợp trong điều kiện chân không hoàn toàn, điều này rất tốn kém (~ 1000 USD cho mỗi kilogram titan disulfide vào những năm 1970). Khi tiếp xúc với không khí, titan disulfide phản ứng tạo thành các hợp chất hydro sulfide có mùi khó chịu. Vì lý do này và các lý do khác, Exxon đã ngừng sản xuất pin titan disulfide - lithium này của Whittingham. Pin sử dụng điện cực kim loại lithium đã gặp phải các vấn đề về an toàn, vì lithium là một chất phản ứng mạnh; Nó cháy trong điều kiện khí quyển bình thường do có nước và oxy trong không khí. Vì vậy, nghiên cứu đã chuyển sang phát triển pin không sử dụng kim loại lithium, mà sử dụng các hợp chất hóa học của lithium, có khả năng chấp nhận và giải phóng các ion lithium.
Pin Li-ion lần đầu được thương mại hóa nhờ Sony Energitech vào năm 1991. Ngày nay, pin Li-ion đã trở thành loại pin chiếm thị phần lớn trong thị trường pin cho các thiết bị di động trên toàn cầu.
Nguyên lý hoạt động
Các chất tham gia phản ứng điện hóa trong pin lithium-ion bao gồm các nguyên liệu cho điện cực âm và dương, và dung dịch điện ly cung cấp môi trường dẫn cho ion lithium di chuyển giữa hai điện cực. Dòng điện chạy trong mạch ngoài khi pin hoạt động.
Ion lithium di chuyển qua cả hai điện cực trong quá trình phản ứng. Hầu hết các nguyên liệu cho điện cực hiện nay đều là các vật liệu cho phép ion lithium xâm nhập và di chuyển giữa mạng tinh thể mà không làm xáo trộn vị trí của các nguyên tử khác trong mạng, trong quá trình xâm nhập và rời khỏi mạng tinh thể.
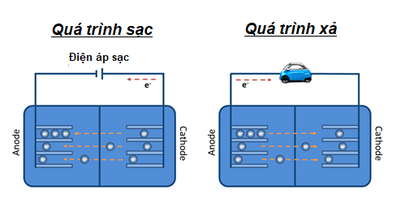
Khi xả pin, ion lithi (mang điện dương) di chuyển từ cực âm (anode), thường là graphite, C6, qua dung dịch điện ly, đến cực dương, nơi vật liệu dương cực phản ứng với ion lithi. Để cân bằng điện tích giữa hai cực, mỗi ion Li di chuyển từ cực âm sang cực dương (cathode) trong pin, ở mạch ngoài, một electron di chuyển từ cực âm sang cực dương, tạo ra dòng điện chạy từ cực âm sang cực dương (vì electron mang điện tích âm).
Trong quá trình sạc, điện tử di chuyển ngược lại: dưới điện áp sạc, electron chuyển từ điện cực dương của pin (cực âm) sang cực dương, khi ion Li tách khỏi cực dương và di chuyển trở lại cực âm của pin (cực dương). Do đó, pin đảo chiều trong quá trình sạc và xả. Xác định tên gọi cực dương hay cực âm dựa vào bản chất phản ứng và quá trình phản ứng được theo dõi. Trong nghiên cứu này (và trong hầu hết các nghiên cứu khoa học), cực âm (anode) và cực dương (cathode) của pin luôn được gọi là cực dương và cực âm tương ứng.
Phản ứng tại cực dương (cathode) trong vật liệu lớp LCO được viết như sau (sạc ngược, xả thuận):
LiCoO2 CoO2 + Li + e
Phản ứng tại cực âm (anode) trong vật liệu lớp graphite (sạc ngược, xả thuận):
C6 + Li + e LiC6
Phản ứng toàn phần của pin (sạc theo chiều thuận, xả theo chiều nghịch)
C6 + LiCoO2 LiC6 + CoO2
Khi sạc, C6 (anode) bị khử thành LiC6, Co bị oxy hóa thành CoO2, và ngược lại khi xả.
Các phản ứng luôn có giới hạn. Nếu xả quá mức (dẫn đến sự dư thừa ion lithi), lithi cobalt oxide đã bão hòa sẽ chuyển thành lithi oxide theo phản ứng sau:
LiCoO2 + Li + e → Li2O + CoO
Nếu sạc quá 5,2 V, pin LCO sẽ tạo thành cobalt IV oxide, theo phản ứng một chiều đã được kiểm chứng bằng phương pháp nhiễu xạ tia X.
LiCoO2 → Li + e + CoO2
Cấu tạo của pin
Điện cực dương (Cathode)
Vật liệu được sử dụng làm điện cực dương thường là LiCoO2 và LiMnO4. Cấu trúc pseudo-tứ diện của coban giúp khuếch tán ion lithium theo 2 chiều. Chúng có nhiệt dung riêng cao, dung tích lớn, khả năng tự xả thấp, điện thế xả cao và hiệu suất chu trình tốt. Tuy nhiên, giá cao do chứa cobalt, một kim loại hiếm, và không bền nhiệt. Mangan với hệ tinh thể lập phương cho phép ion lithi khuếch tán theo cả ba chiều. Mangan rẻ tiền và phổ biến hơn cobalt, có hiệu năng cao hơn và vòng đời dài hơn, mặc dù cần khắc phục những hạn chế như khả năng hòa tan và giảm công suất pin. Các nghiên cứu đang tập trung vào việc phát triển các vật liệu khác nhằm giảm chi phí và tăng hiệu suất pin. Ví dụ, vào năm 2017, LiFePO4 được kỳ vọng sẽ áp dụng rộng rãi trong các pin lớn như pin cho xe điện vì giá thành thấp và công suất cao, mặc dù vật liệu này kém dẫn điện và yêu cầu sử dụng phụ gia dẫn điện carbon.
| Điện cực dương | ||||
| Hợp chất | Công ty | Ứng dụng | Năm | Ưu điểm |
| Lithi nickel Mangan cobalt Oxide (NMC, LiNixMnyCozO2) | Imara Corporation, Nissan Motor, Microvast Inc., LG Chem | Xe điện, dụng cụ điện, grid energy storage | 2008 | Năng lượng riêng và mật độ năng lượng riêng cao |
| Lithi Mangan Oxide (LMO, LiMn2O4) | LG Chem, NEC, Samsung, Hitachi, Nissan/AESC, EnerDel | Xe điện hybrid, điện thoại, laptop | 1996 | Giá rẻ, bền, năng lượng riêng cao |
| Lithi Sắt Phosphate (LFP, LiFePO4) | University of Texas/Hydro-Québec, Phostech Lithium Inc., Valence Technology, A123Systems/MIT | Segway Personal Transporter, dụng cụ điện, sản phẩm hàng không, automotive hybrid systems, PHEV conversions | 1996 | Mật độ năng lượng ở mức trung bình (2 A·h outputs 70 amperes) An toàn, bền nhiệt. |
| Lithi Cobalt Oxide (LCO,LiCoO2) | Sản phẩm thương mại đầu tiên của Sony | Đa dạng | 1991 | Năng lượng riêng cao |
| Lithi nickel cobalt Nhôm Oxide (NCA, LiNiCoAlO2) | Panasonic, Saft Groupe S.A. | Xe điện | 1999 | Năng lượng riêng cao, vòng đời dài |
Điện cực Âm (Anode)
Vật liệu điện cực âm thường sử dụng là graphite và các vật liệu carbon khác. Chúng rất phổ biến với độ dẫn điện tốt và có cấu trúc cho phép ion lithium xen kẽ vào giữa các lớp trong mạng carbon, giúp dự trữ năng lượng với khả năng phình ra tới 10%. Silicon cũng được dùng như một vật liệu âm cực vì khả năng chứa ion lithium nhiều hơn so với carbon. Tuy nhiên, khi chứa ion lithium, silicon có thể phình ra đến hơn 400% so với thể tích ban đầu, dẫn đến phá vỡ cấu trúc pin.
| Điện cực âm | |||||
| Hợp chất | Dung lượng | Công ty | Ứng dụng | Năm | Nhận xét |
| Graphite | 372 mAh/g | Là vật liệu chính cho cực âm trong hầu hết các LIB | 1991 | Giá rẻ. Tốc độ sạc phụ thuộc nhiều vào cấu trúc, kích thước hình dạng của từng lớp graphene. | |
| Lithi Titanate ("LTO", Li4Ti5O12) | 175 mAh/g | Toshiba, Altairnano | Ô tô (Phoenix Motorcars), điện lưới dự trữ (PJM Interconnection Regional Transmission Organization control area, United States Department of Defense), bus (Proterra) | 2008 | Dòng điện, thời gian sạc, độ bền (an toàn, bền nhiệt, có thể chạy trong khoảng −50–70 °C (−58–158 °F)) |
| Hard Carbon | 540 mAh/g | Energ2 | Dụng cụ điện gia đình | 2013 | Dung lượng lớn |
| Hợp kim thiếc cobalt (CoSnx) | lên đến 992 mAh/g | Sony | Dụng cụ điện (Sony Nexelion battery) | 2005 | Dung lượng lớn hơn pin graphite (3.5Ah 18650-type battery) |
| Silicon/Carbon | Volumetric: 580 W·h/l | Amprius | Smartphones, với công suất 5000 mA·h | 2013 | Cần có cấu trúc nano với hàm lượng silicon <10% khối lượng. |
Silicon có thể được sử dụng làm điện cực âm, tuy nhiên phản ứng với Li có thể gây nứt gãy vật liệu. Việc này có thể dẫn đến việc lớp silicon bên trong tiếp xúc trực tiếp với dung dịch điện ly, gây ra sự hình thành lớp điện ly rắn giao pha (SEI) trên bề mặt mới của silicon. Lớp SEI này có thể dày lên và ngăn chặn quá trình khuếch tán của Li+ trong pin, dẫn đến giảm dung lượng và công suất của pin cũng như độ bền của điện cực âm. Nhiều nỗ lực nghiên cứu đang được tiến hành nhằm giảm thiểu hiện tượng nứt gãy của silicon, ví dụ như tổng hợp silicon dưới dạng nano sợi, ống nano, khối cầu hình rỗng, hạt nano và các cấu trúc xốp nano.
Dung dịch điện ly (electrolyte)
Dung dịch điện ly hoặc chất điện ly là môi trường truyền ion lithi giữa các điện cực trong quá trình sạc và xả pin. Nguyên tắc cơ bản của dung dịch điện ly cho pin Li-ion là có độ dẫn ion tốt, đặc biệt là độ dẫn ion lithi đạt khoảng 10 S/cm ở nhiệt độ phòng, có thể tăng thêm 30-40% ở 40°C và giảm nhẹ khi xuống 0°C. Trong quá trình di chuyển ion lithi, pin tạo ra dòng điện trong mạch ngoài để đảm bảo phản ứng xảy ra trong pin mà không gây đoản mạch. Do đó, dung dịch điện ly cần đảm bảo là chất cách điện tốt với độ dẫn electron không quá 10 S/cm. Dung dịch điện ly cho pin Li-ion thường chứa muối lithi như LiPF6, LiBF4 hoặc LiClO4 trong các dung môi hữu cơ như etylen cacbonat, dimetyl cacbonat và dietyl cacbonat.
Trong lần sạc đầu tiên, do các dung môi hữu cơ thường dễ phân hủy ở cực âm, thường sẽ hình thành lớp điện ly rắn giao pha (SEI), có thể làm giảm độ dẫn của điện cực âm. Tuy nhiên, lớp giao pha này cũng có thể ngăn chặn sự phân hủy của dung dịch điện ly và từ đó tạo thành một lớp giao diện bền.
Dung dịch điện ly composite dựa trên polymer hữu cơ POE (poly(oxyethylene)) cũng có thể là một lớp giao diện bền. Nó có thể được sử dụng để bảo vệ bề mặt điện cực trong pin Li-polyme và những pin Li-ion thông thường khác.
Để giảm thiểu sự rò rỉ của dung dịch điện ly với dung môi hữu cơ và tăng tính an toàn cũng như giảm khả năng cháy, các nghiên cứu tập trung vào phát triển dung môi gel, polymer hoặc các chất điện ly dạng rắn từ ceramic.
Khi sử dụng chất điện ly dạng rắn (solid electrolyte), pin Li-ion sẽ trở thành pin dạng rắn, loại bỏ lớp màng ngăn và đơn giản hóa quá trình lắp ráp, từ đó tăng tính an toàn cho pin.
Cơ chế sạc và thải điện của pin
Quá trình điều chỉnh sạc và thải pin Lithium-ion đơn và hệ thống pin Lithium-ion toàn diện, bao gồm nhiều pin được kết nối tiếp theo cách khác biệt.
Đối với một tế bào pin Lithium-ion được sạc và thải qua hai giai đoạn:
1 – Chế độ dòng điện không thay đổi: dòng điện không đổi (CC)
2 – Chế độ điện áp không thay đổi: điện áp không đổi (CV)
Đối với một hệ thống pin Lithium-ion hoàn chỉnh, cần 3 giai đoạn
1 – Chế độ dòng điện không thay đổi: dòng điện không đổi (CC)
2 – Cân bằng
3 – Chế độ điện áp không thay đổi: điện áp không đổi (CV)
Ở chế độ dòng điện không đổi, bộ sạc sẽ áp dòng điện không đổi lên pin thông qua một điện áp ổn định tăng dần cho đến khi đạt đến điện áp tối đa của pin. Ở chế độ cân bằng, bộ sạc giảm dần dòng điện sạc lên pin, hoặc điều chỉnh bật tắt dòng điện sạc để từng tế bào pin đạt trạng thái cân bằng trong mạch, cho đến khi tất cả các tế bào trong mạch đều cân bằng. Một số thiết bị sạc điều chỉnh cân bằng bằng cách sạc từng tế bào pin lần lượt, tuy nhiên điều này kéo dài thời gian sạc, việc tối ưu hóa thuật toán quá trình cân bằng này có thể tăng hiệu suất và tối ưu hóa thời gian sạc pin. Ở chế độ điện áp cân bằng, bộ sạc áp một điện áp bằng với điện áp tối đa của mỗi tế bào nhân với số tế bào lắp nối tiếp trên toàn bộ pin, đây chính là quá trình thải, do đó dòng điện sẽ giảm về 0, cho đến khi dòng điện dưới ngưỡng 3% giá trị ban đầu của dòng điện sạc, thì pin sẽ ngừng hoạt động. Nếu sạc/xả vượt quá ngưỡng điện năng và dòng điện cho phép, có thể gây nổ pin.
Nhiệt độ vận hành
Nhiệt độ giới hạn khi sạc pin quan trọng hơn nhiệt độ khi sử dụng (nhiệt độ hoạt động). Các nhà khoa học nhận thấy rằng việc hoạt động ở nhiệt độ quá cao sẽ làm giảm tuổi thọ pin. Pin hoạt động tốt nhất khi sạc ở 5-45°C, khi đó có thể sạc nhanh. Ở nhiệt độ thấp hơn, từ 0-5°C có thể sạc được nhưng dòng điện sẽ giảm, và trong quá trình sạc, nhiệt độ của pin sẽ tăng lên do điện trở nội. Hiện tượng tăng nhiệt độ khi sạc là nguyên nhân chính làm giảm hiệu suất pin, khi nhiệt độ vượt quá 45°C, pin sẽ nhanh chóng bị chai. Tuy nhiên, khi sạc ở nhiệt độ thấp, điện trở nội của pin lại tăng, làm giảm tốc độ và kéo dài thời gian sạc.
Pin Lithium-ion không nên sạc ở nhiệt độ dưới 0°C. Ở nhiệt độ này, mặc dù hệ pin vẫn được sạc bình thường, nhưng do điện trở nội cao của vật liệu điện cực, khả năng phản ứng của ion lithium với vật liệu điện cực giảm, khiến lithium được mạ lên bề mặt điện cực thay vì khuếch tán vào sâu bên trong vật liệu và tham gia phản ứng trong điều kiện sạc lạnh. Lớp mạ này sẽ bám chặt trên điện cực dù có tiếp tục sạc hay xả. Vì vậy, hầu hết các pin không thể hoạt động ngoài khoảng 0-45°C vì lý do an toàn.
- John B. Goodenough
- M. Stanley Whittingham
- Yoshino Akira
Đọc thêm
- Andrea, Davide (2010). Hệ thống quản lý pin cho các bộ pin Lithium-Ion lớn. Nhà xuất bản Artech. tr. 234. ISBN 1608071049. Truy cập ngày 3 tháng 6 năm 2013.
- Winter, M; Brodd, RJ (2004). “Các loại pin, tế bào nhiên liệu và siêu điện dung là gì?”. Bài đánh giá hóa học. 104 (10): 4245–69. doi:10.1021/cr020730k. PMID 15669155.
Liên kết ngoài
- Pin Lithium trên DMOZ
- An toàn lưu trữ năng lượng tại Viện Năng lượng tái tạo Quốc gia
- Nghiên cứu cải tiến an toàn cho pin xe điện, Viện Năng lượng tái tạo Quốc gia, Tháng Mười 2015
- Cơ chế suy giảm và dự đoán tuổi thọ cho pin Lithium-Ion - Một góc nhìn điều khiển, Viện Năng lượng tái tạo Quốc gia, Tháng Bảy 2015.
- Địa chỉ ảnh hưởng của biến đổi khí hậu đối với pin Lithium-Ion định dạng lớn cho ứng dụng xe hơi, Viện Năng lượng tái tạo Quốc gia, Tháng Ba 2013.
- IATA. Hàng nguy hiểm (Hazmat): Pin Lithium - Hướng dẫn.
- Nghiên cứu về hiệu suất chống cháy của pin Lithium-Ion và Lithium-Metal trong các ứng dụng khác nhau và đề xuất các khuyến nghị chiến lược (Báo cáo nghiên cứu bằng tiếng Đức, Trung tâm nghiên cứu công nghệ chống cháy, Viện Công nghệ Karlsruhe - KIT) Lưu trữ 2016-01-25 tại Wayback Machine (PDF)
Pin Galvanic | ||
|---|---|---|
| Thể loại |
| |
Pin sơ cấp (không thể sạc) |
| |
Pin sạc (có thể sạc) |
| |
Pin khác |
| |
| Các thành phần của pin |
| |
| ||
