1. Tên gọi khác của Propen là gì?
A. Propilen.
B. Etilen.
C. Acetilen.
D. Propan.
Đáp án chính xác là A.
Propen còn được gọi là propilen, là một hợp chất hữu cơ không no với một liên kết đôi. Nó là chất khí không màu, mùi giống như dầu mỏ và thuộc nhóm anken.
Giải thích cho lựa chọn đáp án A:
Propilen là hợp chất hữu cơ không no với một liên kết đôi, thuộc nhóm anken và là chất khí không màu có mùi tương tự dầu mỏ. Nó cũng được biết đến dưới tên gọi khác là propen.
- Khối lượng phân tử là 42,0797 đvC
- Khối lượng riêng là 1,81 kg/m³
- Nhiệt độ nóng chảy: -185,2°C (87,95 K, -301,36°F)
- Nhiệt độ sôi: -47,3°C (226,15 K, -52,6°F)
Propilen nhẹ hơn nước và chỉ hòa tan một ít trong nước, với độ tan là 0,61 g/m³. Nó không hòa tan trong các dung môi phân cực như nước, chỉ hòa tan trong dung môi không phân cực hoặc ít phân cực.
Propilen không có khả năng dẫn điện.
Một số phản ứng hóa học của propilen bao gồm
- Phản ứng cộng với HBr
CH3-CH=CH2 + HBr → CH3-CH2-CH2-Br
- Phản ứng cộng với halogen
CH3CH=CH2 + Br2 → CH3CHBrCH2Br
CH3CH=CH2 + Cl2 → CH3CHClCH2Cl
- Phản ứng cộng với nước
CH3-CH=CH2 + H2SO4 → CH3-CH-CH3OH + H2O
Lưu ý: Với lượng H2SO4 lớn hơn, tạo thành rượu bậc 2:
CH3-CH=CH2 + H2SO4 → CH3CH-OSO3H
CH3CH-OSO3H + H2O → CH3CH-OH + H2SO4
- Phản ứng cộng với BH3 (axit Lewis)
Axit Lewis là các muối kim loại hóa trị 3 có khả năng nhận một cặp điện tử để tạo liên kết cộng hóa trị phối hợp. Các chất thường dùng bao gồm nhôm clorua, sắt(III) clorua, triflorua bo và ytecbi(III) triflo.
2. Propen có tham gia phản ứng trùng hợp không?
Phản ứng trùng hợp (addition polymerization), hay phản ứng trùng hợp chuỗi, là quá trình tạo ra polyme từ các monome với mắt xích cơ bản giống như monome ban đầu.
Để monome tham gia phản ứng trùng hợp, nó phải có liên kết bội hoặc vòng không ổn định. Propen có khả năng tham gia vào phản ứng này để tạo thành polyme.
Ví dụ: Phương trình phản ứng trùng hợp của propen
nCH2=CH−CH3 t0,p,xt −−−→ (−CH2−CH(−CH3)−)n
3. Một số phương trình phản ứng với H2
3.1. Phương trình phản ứng giữa Propen và H2
CH3-CH=CH2 + H2 → CH3–CH2–CH3 (cần có Ni và nhiệt độ)
C3H6 + H2 → C3H8 (cần có Ni và nhiệt độ)
Để phản ứng giữa C3H6 và H2 diễn ra, cần có điều kiện nhiệt độ và xúc tác niken.
3.2. Phản ứng cộng của Anken với H2
Anken chứa liên kết đôi π, vốn kém bền hơn liên kết đơn σ, vì vậy anken dễ dàng tham gia các phản ứng cộng, trùng hợp và oxi hóa.
Anken phản ứng cộng với hidro (Anken + H2)
Khi đun nóng với xúc tác niken, anken sẽ phản ứng với hidro để tạo thành ankan tương ứng.
Anken cộng với H2 tạo thành Ankan
CH2=CH2 + H2 → CH3-CH3
Tổng quát: CnH2n + H2 → CnH2n+2
4. Một số câu hỏi áp dụng liên quan
Câu 1. Quy tắc Maccopnhicop được áp dụng trong trường hợp nào dưới đây?
A. Phản ứng cộng của Br2 với anken đối xứng.
C. Phản ứng cộng HX vào anken đối xứng.
B. Phản ứng trùng hợp của anken.
D. Phản ứng cộng HX vào anken không đối xứng.
Đáp án chính xác: D
Câu 2. Khi but-1-en phản ứng với dung dịch HBr, theo quy tắc Maccopnhicop, sản phẩm chính là gì?
A. CH3-CH2-CHBr-CH2Br.
C. CH3-CH2-CHBr-CH3.
B. CH2Br-CH2-CH2-CH2Br.
D. CH3-CH2-CH2-CH2Br.
Đáp án chính xác: C
Câu 3. Hỗn hợp khí X gồm C3H4, C2H2 và H2 được đưa vào bình kín 8,96 lít (đktc) chứa bột Ni và được nung nóng. Sau phản ứng, thu được hỗn hợp khí Y. Biết tỉ khối của X so với Y là 0,75. Số mol H2 tham gia phản ứng là
A. 0,75 mol
B. 0,30 mol
C. 0,10 mol
D. 0,60 mol
Đáp án chính xác: C
Giải thích:
nX = 0,4 mol
Tỉ số dX : Y = MY : nY = nY : 0,4 = 0,75 dẫn đến nY = 0,3 mol
⇒ Số mol H2 phản ứng = sự chênh lệch mol = nX - nY = 0,4 - 0,3 = 0,1 mol
Câu 4: Một hỗn hợp khí X gồm etan, propan và propen, thể tích 4,48 lít, được cho qua dung dịch brom dư, khối lượng brom tăng 4,2 gam. Khi đốt cháy hoàn toàn lượng khí còn lại thu được 6,48 gam nước. Tính phần trăm thể tích của các khí trong hỗn hợp.
Giải pháp:
Tổng số mol của hỗn hợp X là: nX = 4,48 : 22,4 = 0,2 mol
Khối lượng tăng của brom là do propen: mpropen = 4,2 gam
Vì vậy, số mol propen = 4,2 : 42 = 0,1 mol
Phương trình phản ứng với brom: C3H6 + Br2 → C3H6Br2
Các khí thoát ra bao gồm: C2H6 và C3H8.
Phương trình phản ứng cháy của C2H6 và C3H8
C2H6 + 7/2 O2 - tº → 2 CO2 + 3 H2O
C3H8 + 5 O2 - tº → 3 CO2 + 4 H2O
Số mol H2O = 6,48 : 18 = 0,36 mol
Giả sử số mol của etan và propan lần lượt là x và y mol
Chúng ta có:
x + y = 0,2 - 0,1 = 0,1 (1);
3x + 4y = 0,36 (2)
Từ hệ phương trình (1) và (2) ta có x = 0,04 và y = 0,06
Tính phần trăm thể tích của từng khí trong hỗn hợp ban đầu:
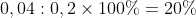
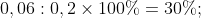
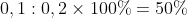
Câu 5: Khi cho 6,72 lít (đktc) hỗn hợp X chứa etilen và propilen vào dung dịch brom, dung dịch brom trở nên nhạt màu và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 9,8 gam. Vậy phần trăm thể tích của etilen trong hỗn hợp X là bao nhiêu?
Hướng dẫn giải:
Gọi số mol của C2H4 là x và số mol của C3H6 là y
Ta có: x + y = 6,72 / 22,4 và 28x + 4y = 9,8
Từ đó suy ra: x = 0,2 và y = 0,1
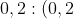
Câu 6: Hỗn hợp khí X chứa 0,3 mol H2 và 0,1 mol propen. Sau khi nung X với xúc tác Ni, hỗn hợp khí Y thu được có tỉ khối so với H2 là 16. Tính số mol H2 đã tham gia phản ứng?
Giải pháp:
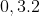
⇒ nY = 4,8 / 32 = 0,15 mol
Do đó, số mol H2 đã phản ứng được tính như sau:
nH2 phản ứng = 0,4 - 0,15 = 0,25 mol
Câu 7: Khi ankađien A phản ứng với dung dịch brom tạo ra sản phẩm CH3C(CH3)BrCH = CHCH2Br. Vậy ankađien A là gì?
A. 2-metylpenta-1,3-đien.
B. 2-metylpenta-2,4-đien.
C. 4-metylpenta-1,3-đien.
D. 2-metylbuta-1,3-đien.
Đáp án chính xác là C
Câu 8: Khi đun nóng 20,16 lít hỗn hợp khí X chứa C2H4 và H2 với xúc tác Ni, ta thu được 13,44 lít hỗn hợp khí Y. Khi cho Y đi qua dung dịch Br2 dư thì thấy khối lượng bình tăng thêm 2,8 gam. Vậy hiệu suất của phản ứng hidro hóa anken là bao nhiêu?
Kết quả:
nX = 20,16 / 22,4 = 0,9 mol;
nY = 13,44 / 22,4 = 0,6 mol;
Số mol nH2 phản ứng = 0,9 - 0,6 = 0,3 mol;
Số mol anken dư = 2,8 / 28 = 0,1 mol;
Số mol anken ban đầu = 0,1 + 0,3 = 0,4 mol
Vì vậy, số mol nH2 ban đầu = 0,5 mol
Câu 9: Một hỗn hợp X bao gồm 0,12 mol C2H2 và 0,18 mol H2. Khi cho X đi qua Ni nung nóng, sau một thời gian thu được hỗn hợp khí Y. Khi cho Y vào bình chứa brom dư, thấy bình brom tăng m gam và có khí Z thoát ra. Đốt cháy khí Z và cho sản phẩm cháy vào dung dịch Ca(OH)2 dư, thấy có 5 gam kết tủa xuất hiện và khối lượng dung dịch giảm 1,36 gam. Tính giá trị của m?
Giải đáp:
Khối lượng của hỗn hợp X tính được là: mX = 0,12 × 26 + 0,18 × 2 = 3,48 g
Khi cho X đi qua Ni nung nóng:
Phương trình phản ứng xảy ra là: C2H2 + H2 → C2H4; C2H2 + 2H2 → C2H6
Hỗn hợp Y bao gồm: C2H2, C2H4, C2H6 và H2
Khi cho Y qua bình chứa Br2 dư, C2H2 và C2H4 sẽ bị giữ lại. Hỗn hợp Z còn lại gồm: C2H6 và H2
Phương trình phản ứng được mô tả như sau:
C2H4 + Br2 → C2H4Br2;
C2H2 + 2Br2 → C2H2Br4
Khi đốt cháy Z, sản phẩm thu được là CO2 và H2O:
Số mol CO2 = số mol CaCO3 = 0,05 mol.
mdd giảm = m↓ - (mH2O + mCO2), do đó mH2O = 5 - 1,36 - 0,05.44 = 1,44 g
Số mol H2O: nH2O = 1,44 / 18 = 0,08 mol ⇒ mZ = 0,08.2 + 0,05.12 = 0,76 g
Khối lượng bình brom thay đổi: m = mX - mZ = 3,48 - 0,76 = 2,72 g
Câu 10: Trong phản ứng cộng but-1-in với H2 theo tỷ lệ mol 1:1, sử dụng xúc tác Pd/PbCO3, sản phẩm hữu cơ tạo thành là gì?
A. But - 1 - en
B. Butan
C. But - 2 - en
D. Cả B và C đều chính xác
Đáp án chính xác là: Đáp án A
Cảm ơn quý khách đã theo dõi bài viết từ Mytour.
