
| Natri silicat | |
|---|---|
Structural formula of polymeric sodium silicate | |
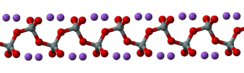
Ball and stick model of polymeric sodium silicate | |
| Danh pháp IUPAC | Sodium metasilicate |
| Tên khác | Liquid glass Waterglass |
| Nhận dạng | |
| Viết tắt | E550 |
| Số CAS | 6834-92-0 |
| PubChem | 23266 |
| Số EINECS | 229-912-9 |
| MeSH | Sodium+metasilicate |
| ChEBI | 60720 |
| Số RTECS | VV9275000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ |
| InChI | đầy đủ |
| Thuộc tính | |
| Công thức phân tử | Na2SiO3 |
| Bề ngoài | White to greenish opaque crystals |
| Khối lượng riêng | 2.61 g/cm³ |
| Điểm nóng chảy | 1.088 °C (1.361 K; 1.990 °F) |
| Điểm sôi | |
| Độ hòa tan trong nước | 22.2 g/100 ml (25 °C) 160.6 g/100 ml (80 °C) |
| Độ hòa tan | không hòa tan trong alcohol |
| Chiết suất (nD) | 1.52 |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH298 | −1561.43 kJ/mol |
| Entropy mol tiêu chuẩn S298 | 113.71 J/(K·mol) |
| Nhiệt dung | 111.8 J/(K·mol) |
| Các nguy hiểm | |
| Phân loại của EU | C |
| NFPA 704 |
0
2
0
|
| Chỉ dẫn R | R34, R37 |
| Chỉ dẫn S | (S1/2), S13, S24/25, S36/37/39, S45 |
| LD50 | 1153 (đường miệng, chuột) |
| Các hợp chất liên quan | |
| Anion khác | Natri cacbonat |
| Cation khác | Kali silicat |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |
Silicat natri (tiếng Anh: Sodium silicate) hay còn gọi là thủy tinh lỏng, là tên chung cho các hợp chất có công thức (Na2O)(SiO2)n, chẳng hạn như natri metasilicat Na2SiO3, natri orthosilicat Na4SiO4, và natri pyrosilicat Na6Si2O7. Các hợp chất này thường có dạng chất rắn trong suốt hoặc bột màu trắng hòa tan trong nước, nhưng sản phẩm thương mại thường có màu xanh do tạp chất.
Trong ngành công nghiệp, các loại natri silicat khác nhau được phân loại theo tỷ lệ khối lượng SiO2:Na2O (có thể chuyển đổi sang tỷ lệ mol bằng cách nhân với 1,032). Tỷ lệ này có thể dao động từ 1:2 đến 3,75:1. Những loại có tỷ lệ dưới 2.85:1 có tính kiềm, trong khi những loại có tỷ lệ SiO2:Na2O cao hơn được coi là trung tính.
Silicat natri được áp dụng trong sản xuất xi măng, chống cháy thụ động, ngành dệt may và chế biến gỗ, vật liệu chịu lửa, và silica gel.
Diễn biến lịch sử
Các hợp chất silicat của kim loại kiềm đã được các nhà giả kim châu Âu ghi nhận từ thế kỷ 16. Giambattista della Porta vào năm 1567 đã lưu ý rằng tartari salis (kem tartar, kali bitartrat) giúp thạch anh chảy ở nhiệt độ thấp hơn. Những tài liệu tham khảo khác về các hợp chất này được Basil Valentine vào năm 1520 và Georgius Agricola vào năm 1550 đưa ra. Khoảng năm 1640, Jean Baptist van Helmont đã phát hiện ra sự hình thành các hợp chất silicat của kim loại kiềm bằng cách nung chảy cát với kiềm dư và nhận thấy rằng SiO2 có thể được kết tủa bằng cách thêm axit vào dung dịch.
Vào năm 1646, Glauber đã tổng hợp kali silicat, mà ông gọi là rượu silicum, bằng cách nung chảy kali cacbonat (thu được từ việc nung kem tartar) và cát trong nồi kim loại cho đến khi không còn sủi bọt khí (do giải phóng carbon dioxide). Hỗn hợp sau đó được làm nguội và nghiền thành bột mịn. Khi bột tiếp xúc với không khí ẩm, nó dần chuyển thành chất lỏng nhớt, mà Glauber đặt tên là 'Oleum oder Liquor Silicum, Arenæ, vel Crystallorum' (dầu hoặc chất lỏng chứa silic, cát hoặc tinh thể).
Tuy nhiên, các chất mà các nhà giả kim đó chế tạo không giống như thủy tinh hiện đại. Điều này đã được Johann Nepomuk von Fuchs phát hiện vào năm 1818, khi xử lý axit silicic với kim loại kiềm; sản phẩm thu được hòa tan trong nước, 'nhưng không bị ảnh hưởng bởi sự thay đổi khí quyển'.
Thuật ngữ 'thủy tinh nước' và 'thủy tinh hòa tan' được Leopold Wolff giới thiệu vào năm 1846, Émile Kopp vào năm 1857 và Hermann Krätzer vào năm 1887.
Đặc điểm

Silicat natri là một chất rắn không màu hoặc bột trắng, dễ hòa tan trong nước nhưng không tan trong cồn.
Silicat natri duy trì sự ổn định trong dung dịch trung tính và kiềm. Trong môi trường axit, các ion silicat phản ứng với ion hydro để tạo thành axit silicic, thường phân hủy thành gel silic dioxide ngậm nước.
Khi được đun nóng, silicat natri chuyển thành một chất rắn trong suốt gọi là silica gel, được dùng làm chất hút ẩm. Nó có thể chịu được nhiệt độ lên tới 1100°C.
Quy trình sản xuất
Dung dịch silicat natri có thể được chế tạo bằng cách xử lý hỗn hợp silica (thường là cát thạch anh), xút và hơi nước nóng trong lò phản ứng.
Silicat natri cũng có thể được tạo ra bằng cách hòa tan SiO2 (nóng chảy ở 1713°C) trong natri cacbonat nóng chảy (nóng chảy ở 851°C).
Hợp chất này cũng có thể được tạo ra từ natri sunfat với cacbon làm chất khử.
Sắt silic
Natri silicat có thể được sản xuất trong quá trình chế tạo hydro bằng cách hòa tan sắt silic trong dung dịch natri hydroxit.
Công nghệ Bayer
Mặc dù không tạo ra lợi nhuận, Na2SiO3 là một sản phẩm phụ của quy trình Bayer, thường được chuyển đổi thành canxi silicat (Ca2SiO4).
Ứng dụng
Natri silicat chủ yếu được sử dụng trong các chất tẩy rửa, ngành công nghiệp giấy, xử lý nước, và làm vật liệu xây dựng.
Xem thêm
- Từ điển Hóa chất Công nghiệp của Ashford, ấn bản thứ ba, 2011, trang 8369.
Các liên kết tham khảo
- Trung tâm Nghiên cứu Silicat Châu Âu
- Thẻ An toàn Hóa chất Quốc tế 1137
- ChemSub Online: Axit silicic, muối natri
- ChemSub Online: Natri metasilicat
