1. Tổng quan lý thuyết Hóa học Chương 3: Liên kết hóa học
1.1 Liên kết ion
1.1.1 Định nghĩa
Liên kết ion trong phân tử hoặc tinh thể hình thành nhờ lực hút tĩnh điện giữa các ion mang điện tích đối ngược. Liên kết ion thường xuất hiện giữa nguyên tử kim loại và phi kim, tạo thành hợp chất ion.
Lưu ý:
Nguyên tử kim loại mất electron để trở thành ion dương (cation), trong khi nguyên tử phi kim nhận electron để thành ion âm (anion).
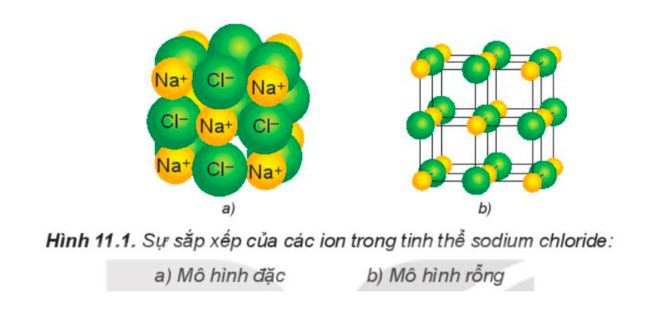
1.1.2. Tinh thể ion
Cấu trúc mạng tinh thể ion: các ion được bố trí theo một mạng lưới nhất định trong không gian, với các ion dương và âm luân phiên, liên kết chặt chẽ nhờ sự cân bằng giữa lực hút và lực đẩy.
Ví dụ: Tinh thể của muối ăn.
1.2 Liên kết cộng hóa trị
1.2.1. Khái niệm cơ bản
- Liên kết cộng hóa trị hình thành khi hai nguyên tử chia sẻ một hoặc nhiều cặp electron.
Các loại liên kết: Liên kết đơn (–), liên kết đôi (=), liên kết ba (º).
- Liên kết cộng hóa trị không phân cực là khi cặp electron chung không bị kéo lệch về phía nguyên tử nào trong phân tử.
Ví dụ: Liên kết trong phân tử Cl2, O2, N2, ... là liên kết cộng hóa trị không phân cực.
- Liên kết cộng hóa trị phân cực xảy ra khi cặp electron chung bị kéo lệch về phía nguyên tử có độ âm điện cao hơn.
Ví dụ: Liên kết trong phân tử HCl là liên kết cộng hóa trị phân cực, với cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl).
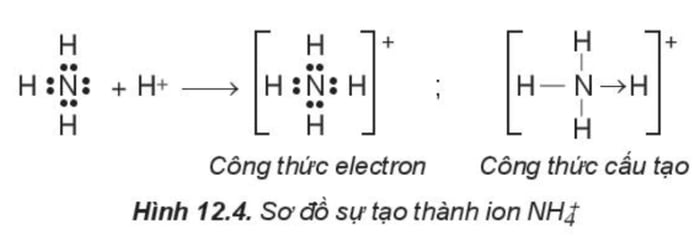
- Liên kết cho – nhận là loại liên kết trong đó cặp electron chung được cung cấp hoàn toàn từ một nguyên tử.
Ví dụ:
1.2.2 Độ âm điện và liên kết hóa học
Dựa vào sự khác biệt về độ âm điện giữa các nguyên tử, có thể xác định loại liên kết giữa chúng.
1.3 Liên kết hydrogen và tương tác van der Waals
Định nghĩa
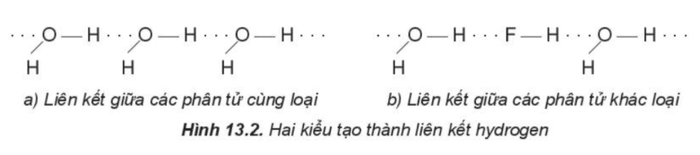
- Liên kết hydrogen hình thành khi nguyên tử H (đã liên kết với một nguyên tử có độ âm điện cao) kết hợp với một nguyên tử khác (cũng có độ âm điện cao) mà vẫn còn cặp electron hóa trị chưa tham gia liên kết.
Ví dụ:
- Tương tác van der Waals là lực tĩnh điện giữa các nguyên tử hoặc phân tử, diễn ra giữa các cực của chúng.
Ví dụ: Trong trạng thái lỏng, các phân tử bromine có sự tương tác yếu gọi là tương tác van der Waals.
1.4 Tác động của liên kết hydrogen và tương tác van der Waals
Liên kết hydrogen và tương tác van der Waals đều làm tăng nhiệt độ nóng chảy và sôi của các chất.
2. Trắc nghiệm Hóa học Chương 3: Liên kết hóa học
Câu 1: Phát biểu nào dưới đây là chính xác?
A. Liên kết cộng hóa trị phân cực có thể được xem là dạng trung gian giữa liên kết cộng hóa trị không phân cực và liên kết cho – nhận.
B. Liên kết ion có thể được coi là dạng trung gian giữa liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực.
C. Liên kết cộng hóa trị không phân cực có thể được coi là dạng trung gian giữa liên kết cộng hóa trị phân cực và liên kết ion.
D. Liên kết cộng hóa trị phân cực có thể được coi là dạng trung gian giữa liên kết cộng hóa trị không phân cực và liên kết ion.
Đáp án: D
Giải thích:
Liên kết cộng hóa trị phân cực có thể được xem như là dạng trung gian giữa liên kết cộng hóa trị không phân cực và liên kết ion.
Câu 2: Liên kết đơn là liên kết
A. có một cặp electron được chia sẻ.
B. có hai cặp electron được chia sẻ.
C. có ba cặp electron được chia sẻ.
D. có bốn cặp electron được chia sẻ.
Đáp án: A
Giải thích:
Liên kết đơn là liên kết có một cặp electron được chia sẻ, được biểu thị bằng một gạch nối (–).
Chú ý:
Liên kết đôi là liên kết có hai cặp electron được chia sẻ, được biểu thị bằng hai gạch nối (=).
Liên kết ba là liên kết có ba cặp electron được chia sẻ, được biểu thị bằng ba gạch nối (≡).
Câu 3: Liên kết ba bao gồm
A. ba liên kết đơn.
B. hai liên kết sigma và một liên kết pi.
C. hai liên kết sigma và hai liên kết pi.
D. một liên kết sigma và hai liên kết pi.
Đáp án: D
Giải thích:
Liên kết ba (º) bao gồm một liên kết sigma (σ) và hai liên kết pi (π).
Câu 4. Trong các chất N2, HCl, HF, O2, Cl2, có bao nhiêu chất có liên kết trong phân tử là liên kết cộng hóa trị không phân cực?
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: C
Giải thích:
Liên kết cộng hóa trị không phân cực xảy ra khi cặp electron chia sẻ đều giữa các nguyên tử mà không bị kéo về một phía nào.
Các phân tử N2, O2, Cl2 đều có liên kết cộng hóa trị không phân cực.
Lưu ý: Liên kết trong phân tử HCl và HF là liên kết cộng hóa trị phân cực, với cặp electron chung bị dịch chuyển về phía nguyên tử có độ âm điện lớn hơn (Cl, F).
Câu 5. Công thức cấu tạo của phân tử N2 là
A. N – N.
B. N=N.
C. N®N.
D. N≡N.
Đáp án: D
Giải thích:
Phân tử nitrogen (N2):
Nguyên tử nitrogen có 5 electron hóa trị, và khi hai nguyên tử nitrogen liên kết với nhau, mỗi nguyên tử đóng góp 3 electron, tạo ra 3 cặp electron dùng chung. Như vậy, trong phân tử N2, mỗi nguyên tử có 8 electron ở lớp ngoài cùng, đáp ứng quy tắc octet.

Hai nguyên tử nitrogen liên kết với nhau bằng ba cặp electron chung (biểu thị bằng ba gạch nối), tạo thành liên kết ba.
Câu 6. Liên kết hóa học hình thành giữa hai nguyên tử nhờ một hoặc nhiều cặp electron chung được gọi là
A. liên kết ion.
B. liên kết cộng hóa trị.
C. liên kết hydro.
D. liên kết kim loại.
Đáp án: B
Giải thích:
Liên kết cộng hóa trị hình thành giữa hai nguyên tử thông qua một hoặc nhiều cặp electron chung.
Câu 7. Liên kết cộng hóa trị phân cực là loại liên kết trong các phân tử mà
A. cặp electron dùng chung bị dịch chuyển về phía nguyên tử có độ âm điện cao hơn.
B. cặp electron dùng chung bị dịch chuyển về phía nguyên tử có độ âm điện thấp hơn.
C. cặp electron dùng chung không bị dịch chuyển về phía nguyên tử nào.
D. cặp electron chung được cung cấp từ một nguyên tử.
Đáp án: A
Giải thích:
Liên kết cộng hóa trị phân cực là loại liên kết trong các phân tử mà cặp electron dùng chung bị kéo về phía nguyên tử có độ âm điện cao hơn.
Ví dụ: Liên kết trong phân tử HCl là liên kết cộng hóa trị phân cực, với cặp electron dùng chung bị kéo về phía nguyên tử có độ âm điện cao hơn (Cl).
Chú ý: Liên kết cộng hóa trị không phân cực là liên kết trong các phân tử mà cặp electron dùng chung không bị kéo về phía nguyên tử nào.
Ví dụ: Liên kết trong các phân tử như Cl2, O2, N2, … là liên kết cộng hóa trị không phân cực.
Câu 8. Liên kết hydro và tương tác van der Waals
A. đều làm tăng cả nhiệt độ sôi và nhiệt độ nóng chảy.
B. đều làm giảm cả nhiệt độ sôi và nhiệt độ nóng chảy.
C. đều làm tăng nhiệt độ sôi và giảm nhiệt độ nóng chảy.
D. đều làm giảm nhiệt độ sôi và tăng nhiệt độ nóng chảy.
Đáp án: A
Giải thích:
Cả liên kết hydro và tương tác van der Waals đều làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Câu 9. Trong các loại liên kết: liên kết cộng hóa trị không phân cực, liên kết cộng hóa trị phân cực và liên kết ion, thì độ phân cực của liên kết
A. giảm theo chiều.
B. tăng theo chiều.
C. không thay đổi.
D. gần như giống nhau.
Đáp án: B
Giải thích:
Trong các loại liên kết: liên kết cộng hóa trị không phân cực, liên kết cộng hóa trị phân cực và liên kết ion, độ phân cực của liên kết tăng theo thứ tự.
Câu 10. Liên kết cộng hóa trị không phân cực thường có hiệu độ âm điện (|Dc|) nằm trong khoảng nào dưới đây?
A. |Dc| ≥ 1,7.
B. 0,4 ≤ |Dc| < 1,7.
C. 0 ≤ |Dc| < 0,4.
D. |Dc| ≥ 2,8.
Đáp án: C
Giải thích:
Khoảng 0 ≤ |Dc| < 0,4 tương ứng với liên kết cộng hóa trị không phân cực.
0,4 ≤ |Dc| < 1,7: Liên kết cộng hóa trị phân cực.
|Dc| ≥ 1,7: Liên kết ion.
Câu 11. Trong các phân tử dưới đây, phân tử nào có liên kết ion?
A. CO2.
B. O2.
C. KCl.
D. HCl.
Đáp án: C
Giải thích:
Liên kết ion được hình thành nhờ lực hút tĩnh điện giữa các ion mang điện tích trái dấu, thường gặp trong các hợp chất giữa kim loại và phi kim, tạo thành các hợp chất ion.
Liên kết trong phân tử KCl là liên kết ion.
Câu 12. Số lượng liên kết sigma và liên kết pi trong phân tử C2H2 lần lượt là
A. 3 và 3.
B. 3 và 2.
C. 2 và 3.
D. 2 và 2.
Đáp án: B
Giải thích:
Công thức cấu tạo của C2H2 là H–C≡C–H.
Liên kết ba (≡) bao gồm một liên kết sigma và hai liên kết pi.
Phân tử C2H2 có 3 liên kết sigma và 2 liên kết pi.
Câu 13. Nhận định nào sau đây là sai về phân tử CO2?
A. Liên kết giữa C và O là liên kết cộng hóa trị phân cực.
B. Phân tử CO2 có cấu trúc là O=C=O.
C. Phân tử CO2 có hình dạng thẳng.
D. Phân tử CO2 không phân cực.
Đáp án: D
Giải thích:
Trong phân tử CO2, độ âm điện của O và C là 3,44 – 2,55 = 0,89.
=> Liên kết C-O là liên kết cộng hóa trị phân cực. Tuy nhiên, vì CO2 có cấu trúc thẳng nên các liên kết đôi (C=O) đối xứng, dẫn đến phân tử CO2 không có độ phân cực tổng thể.
Câu 14. Với giá trị c(Mg) = 1,31 và c(Cl) = 3,16, hãy dự đoán loại liên kết trong phân tử MgCl2.
A. Liên kết cộng hóa trị phân cực.
B. Liên kết cộng hóa trị không phân cực.
C. Liên kết ion.
D. Liên kết cho – nhận.
Đáp án: C
Giải thích:
Trong phân tử MgCl2, chênh lệch độ âm điện giữa Cl và Mg là 3,16 – 1,31 = 1,85, lớn hơn 1,7.
Do đó, liên kết trong MgCl2 là liên kết ion.
Câu 15. Với c(H) = 2,20 và c(Br) = 2,96, hãy xác định loại liên kết trong phân tử HBr.
A. Liên kết cộng hóa trị phân cực.
B. Liên kết cộng hóa trị không phân cực.
C. Liên kết ion.
D. Liên kết cho – nhận.
Đáp án: A
Giải thích:
Trong phân tử HBr, chênh lệch độ âm điện giữa Br và H là 2,96 – 2,20 = 0,76.
Do đó, 0,4 ≤ |Δc| < 1,7, cho thấy liên kết trong HBr là liên kết cộng hóa trị phân cực.
