Chương 1: Các khái niệm về chất, nguyên tử và phân tử
I. KHÁI NIỆM CHẤT
1. Vật thể và bản chất của chất:
Chất là những thành phần cấu tạo nên vật thể
Vật thể bao gồm:
Vật thể tự nhiên như cây cối, đá, trái cây…
Vật thể do con người tạo ra như dao, sách vở…

Hình 1: Một số ví dụ về vật thể tự nhiên
2. Các đặc tính của chất:
-
Mỗi chất đều có các đặc điểm riêng biệt (tính chất đặc trưng).
-
Đặc điểm của chất:
Tính chất vật lý: màu sắc, mùi, vị, khối lượng riêng, kích thước, trạng thái
Tính chất hóa học: khả năng biến đổi từ chất này sang chất khác

Hình 2: Đường là một chất rắn
3. Chất tinh khiết
3.1. Hỗn hợp
- Hỗn hợp: bao gồm hai hoặc nhiều chất được trộn lẫn với nhau.
Ví dụ: Nước biển, nước khoáng, nước muối,… là các hỗn hợp vì chứa nhiều chất hòa tan khác nhau.

Hình 3: Nước khoáng
3.2. Chất tinh khiết
- Chất tinh khiết: là chất không bị pha lẫn với bất kỳ chất nào khác
Ví dụ: Nước cất là một ví dụ về chất tinh khiết vì không chứa tạp chất.

Hình 4: Nước cất
- Chất tinh khiết có các đặc điểm tính chất cụ thể.
Ví dụ: Chỉ nước tinh khiết mới có nhiệt độ đông đặc là 0°C, nhiệt độ sôi là 100°C, và khối lượng riêng là 1 g/cm³. Nước tự nhiên có thể có các giá trị này khác nhau do sự hiện diện của các tạp chất.
3.3. Phương pháp tách chất khỏi hỗn hợp
- Phương pháp tách chất khỏi hỗn hợp dựa trên sự khác biệt về các tính chất vật lý của chúng.
Ví dụ: Để tách muối khỏi dung dịch muối, ta có thể đun nóng dung dịch để nước bay hơi và còn lại muối.

Hình 5: Quá trình tách muối từ dung dịch muối ăn
- Một số phương pháp tách chất dựa vào các đặc tính vật lý của chất bao gồm: chưng cất, cô cạn, lọc, và các phương pháp khác.
II. Nguyên tử
1. Khái niệm
- Tất cả các chất đều được cấu tạo từ nguyên tử. Dù có hàng triệu chất khác nhau, nhưng chỉ có hơn một trăm loại nguyên tử.
- Nguyên tử là các hạt cực kỳ nhỏ và có tính chất điện trung hòa.
Ví dụ: Kim loại natri được tạo thành từ hàng triệu nguyên tử natri.
- Đường kính của một nguyên tử rất nhỏ, khoảng 10–8 cm.
- Cấu tạo của nguyên tử bao gồm:
+ Hạt nhân với điện tích dương.
+ Vỏ nguyên tử chứa một hoặc nhiều electron có điện tích âm.
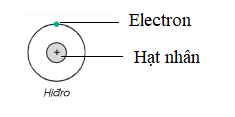
- Electron, ký hiệu e, mang điện tích âm nhỏ nhất và được biểu thị bằng dấu âm (-).
2. Hạt nhân nguyên tử
- Hạt nhân nguyên tử bao gồm các proton và nơtron.
+ Proton, ký hiệu p, mang điện tích dương tương tự như electron nhưng có dấu cộng (+).
+ Nơtron không mang điện, ký hiệu là n.
- Số lượng proton trong một nguyên tử luôn bằng số lượng electron, tức là:
Số p = số e
- Proton và nơtron có khối lượng tương đương, trong khi khối lượng của electron rất nhỏ (khoảng 0,0005 lần khối lượng proton) và thường không được tính đến. Vì vậy, khối lượng hạt nhân được xem như khối lượng của nguyên tử.
3. Lớp electron
- Electron di chuyển rất nhanh xung quanh hạt nhân và được phân bố theo các lớp, mỗi lớp chứa một số electron cố định.
Ví dụ: Nguyên tử natri có 11 electron, chúng phân bố vào 3 lớp electron.
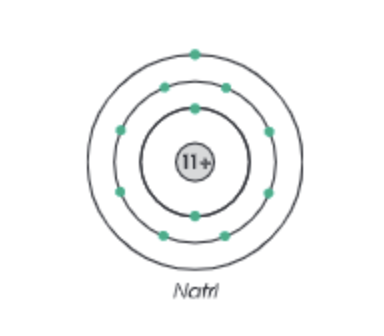
Hình 2: Sơ đồ cấu trúc nguyên tử natri
- Các nguyên tử có thể liên kết với nhau thông qua các electron.
III. NGUYÊN TỐ HÓA HỌC:
1. Định nghĩa: Nguyên tố hóa học là nhóm các nguyên tử giống nhau, với cùng số proton trong hạt nhân.
2. Kí hiệu hóa học
Kí hiệu hóa học: thường là chữ cái đầu (in hoa) của tên Latinh; nếu nhiều nguyên tố có chữ cái đầu giống nhau, thêm chữ cái thứ hai (viết thường).
Ví dụ: Cacbon: C, Canxi: Ca, Đồng: Cu
Kí hiệu hóa học biểu thị một nguyên tử của nguyên tố hóa học cụ thể.
Ví dụ: 2O: Hai nguyên tử oxy.
3. Nguyên tử khối
Nguyên tử khối (NTK) là khối lượng của một nguyên tử, được đo bằng đơn vị cacbon (đvC).
1 đvC tương đương với khối lượng của một nguyên tử cacbon.
1 đvC tương đương với 1,9926 × 10⁻²³ = 1,6605 × 10⁻²⁴ g = 1,6605 × 10⁻²⁷ kg
Ví dụ: Nguyên tử khối của cacbon (C) là 12 đvC, của oxy (O) là 16 đvC
4. Phân tử: Là hạt đại diện cho chất, bao gồm một số nguyên tử kết hợp với nhau và thể hiện đầy đủ các tính chất hóa học của chất.
5. Phân tử khối: Là khối lượng của phân tử tính bằng đơn vị cacbon, bằng tổng của các nguyên tử khối (NTK) của các nguyên tử trong phân tử.
Ví dụ: Phân tử khối của H₂O = 1 × 2 + 16 = 18 đvC
IV. ĐƠN CHẤT – HỢP CHẤT:
1. Đơn chất
- Đơn chất là các chất được hình thành từ một nguyên tố hóa học duy nhất.
- Phân loại: Theo tính chất của nguyên tố, đơn chất được phân thành đơn chất kim loại và đơn chất phi kim.
a) Đơn chất kim loại:
Ví dụ: nhôm, đồng, kẽm, sắt, và các kim loại khác.
+ Có khả năng dẫn điện, dẫn nhiệt tốt, và có ánh kim đặc trưng.
+ Các nguyên tử được sắp xếp chặt chẽ và theo một cấu trúc nhất định.
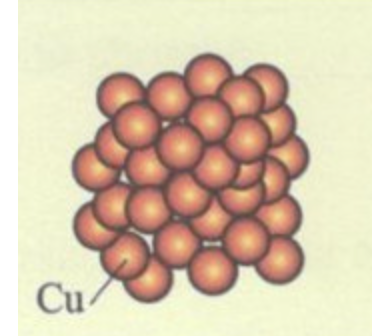
Hình 1: Mô hình đại diện cho mẫu kim loại đồng ở dạng rắn
b) Các đơn chất phi kim:
+ Không sở hữu các đặc tính của kim loại (ngoại trừ than chì có khả năng dẫn điện).
+ Nguyên tử kết hợp theo một quy luật nhất định, thường là cặp đôi.
Ví dụ điển hình: hiđro, oxi, lưu huỳnh,…
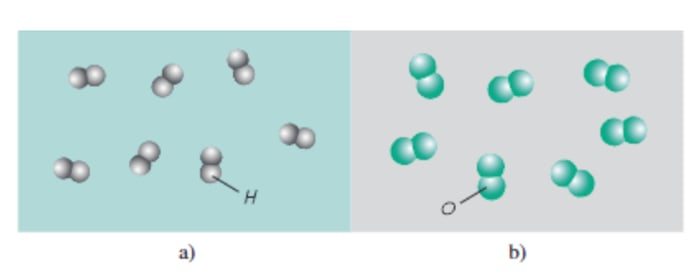
Hình 2: Mô hình đại diện cho khí hiđro (a) và khí oxi (b)
2. Hợp chất
a. Hợp chất là gì?
- Hợp chất là các chất được tạo thành từ ít nhất hai nguyên tố khác nhau.
Ví dụ: Nước gồm hai nguyên tố H và O, muối ăn được tạo thành từ Na và Cl, axit sunfuric bao gồm ba nguyên tố H, S và O,…
- Phân loại các hợp chất:
Hợp chất có thể được phân chia thành:
+ Hợp chất vô cơ, ví dụ như nước, muối ăn, axit sunfuric,…
+ Hợp chất hữu cơ, chẳng hạn như metan, đường, xenlulozơ,…
b. Đặc điểm cấu trúc của hợp chất:
Trong các hợp chất, các nguyên tử của các nguyên tố liên kết với nhau theo một tỷ lệ và thứ tự cố định.
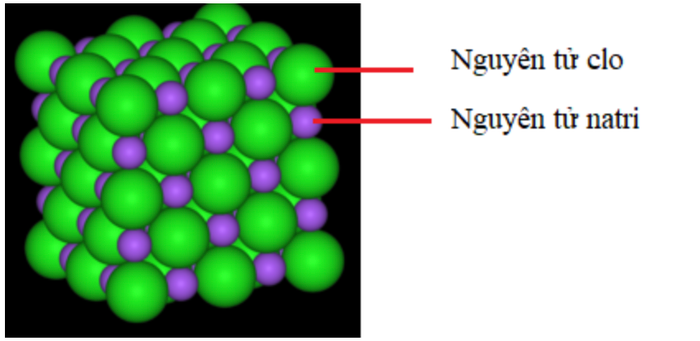
Hình 3: Mô hình đại diện cho một mẫu muối ăn ở dạng rắn
3. Phân tử
a. Khái niệm về phân tử
- Phân tử là phần tử đại diện cho một chất, bao gồm một nhóm nguyên tử liên kết với nhau và biểu thị đầy đủ các đặc tính hóa học của chất đó.
Ví dụ: Phân tử nước bao gồm 2 nguyên tử H liên kết với 1 nguyên tử O; phân tử khí hiđro bao gồm hai nguyên tử giống nhau liên kết với nhau.

Hình 4: Mô hình đại diện cho mẫu nước ở dạng lỏng
- Đối với đơn chất kim loại, nguyên tử đóng vai trò tương tự như phân tử.
b. Khối lượng phân tử
- Tương tự như khối lượng nguyên tử, khối lượng phân tử là khối lượng của phân tử được đo bằng đơn vị cacbon.
- Phương pháp tính: khối lượng phân tử của một chất bằng tổng khối lượng nguyên tử của các nguyên tử trong phân tử của chất đó.
Ví dụ: khối lượng phân tử của nước (H2O) là 1.2 + 16 = 18 đvC
4. Trạng thái của chất
- Mỗi mẫu chất bao gồm một số lượng rất lớn nguyên tử hoặc phân tử.
- Tùy theo nhiệt độ và áp suất, một chất có thể tồn tại ở ba trạng thái:
+ Rắn: các phân tử sắp xếp chặt chẽ và chỉ dao động quanh vị trí cố định.
+ Lỏng: các phân tử gần nhau và có thể trượt qua nhau dễ dàng.
+ Khí: các phân tử cách xa nhau và di chuyển nhanh theo nhiều hướng.
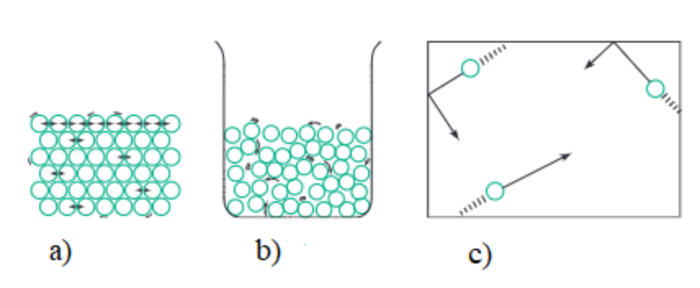
Hình 5: Minh họa ba trạng thái của chất: rắn (a), lỏng (b) và khí (c)
V. CÔNG THỨC HÓA HỌC:
1. Công thức hóa học của đơn chất
- Công thức hóa học của đơn chất chỉ bao gồm ký hiệu hóa học của một nguyên tố duy nhất.
+ Đối với kim loại, vì hạt cấu tạo là nguyên tử, nên ký hiệu hóa học chính là công thức hóa học của chúng.
Ví dụ: Công thức hóa học của đồng và sắt lần lượt là Cu và Fe.
+ Đối với phi kim, nhiều loại phi kim có phân tử cấu thành từ nhiều nguyên tử liên kết với nhau, vì vậy công thức hóa học thường có chỉ số bên dưới ký hiệu để chỉ số nguyên tử liên kết.
Ví dụ: Công thức hóa học của hiđro và oxi là H2 và O2.
+ Một số phi kim, theo quy ước, chỉ sử dụng ký hiệu làm công thức.
Ví dụ: Công thức hóa học của đơn chất than và lưu huỳnh là C và S.
2. Công thức hóa học của hợp chất
- Công thức hóa học của hợp chất bao gồm các ký hiệu hóa học của các nguyên tố cấu tạo nên chất, với chỉ số bên dưới ký hiệu (chỉ số 1 không cần ghi).
- Công thức tổng quát: AxBy ; AxByCz
Trong đó:
+ A, B, C là các ký hiệu hóa học của nguyên tố.
+ x, y, z là các chỉ số nguyên tử của từng nguyên tố trong hợp chất.
Ví dụ: Công thức hóa học của nước là H2O, muối ăn là NaCl, và canxi cacbonat là CaCO3.
3. Ý nghĩa của công thức hóa học
- Công thức hóa học của một chất cung cấp thông tin về:
+ Các nguyên tố cấu thành chất đó.
+ Số lượng nguyên tử của từng nguyên tố có mặt trong một phân tử của chất.
+ Khối lượng phân tử của chất.
- Ví dụ: Công thức hóa học của nước là H2O cho chúng ta biết:
+ Nước bao gồm nguyên tử hiđro và nguyên tử oxi.
+ Mỗi phân tử nước chứa 1 nguyên tử oxi và 2 nguyên tử hiđro.
+ Khối lượng phân tử của nước là 18.
- Một số điểm cần lưu ý:
+ Viết H2 biểu thị 1 phân tử hiđro, khác với việc viết 2 H để chỉ 2 nguyên tử hiđro.
+ Công thức hóa học H2O cho thấy mỗi phân tử nước bao gồm 2 nguyên tử hiđro và 1 nguyên tử oxi. (Gọi là phân tử hiđro trong phân tử nước là không chính xác);
+ Để chỉ ba phân tử hiđro, viết 3 H2; hai phân tử nước viết 2 H2O … Các số như 3, 2 đứng trước là hệ số, viết ngang với ký hiệu.
Chương 2: Các phản ứng hóa học
I. SỰ BIẾN ĐỔI CHẤT
1. Hiện tượng vật lý
- Hiện tượng vật lý xảy ra khi chất thay đổi trạng thái nhưng vẫn giữ nguyên bản chất của nó.
- Ví dụ:
+ Khi nước đá tan ra thành nước lỏng, hoặc khi nước sôi chuyển thành hơi nước và ngược lại, nước thay đổi trạng thái từ rắn sang lỏng rồi sang khí mà vẫn là nước.

Hình 1: Nước thay đổi từ dạng rắn sang dạng lỏng, từ lỏng sang dạng hơi và ngược lại.
+ Khi hòa muối hạt vào nước, bạn sẽ có dung dịch trong suốt mà không thấy hạt muối, nhưng cảm nhận được vị mặn. Khi cô cạn dung dịch, hạt muối sẽ xuất hiện lại. Suốt quá trình, muối vẫn là muối.
2. Hiện tượng hóa học
- Hiện tượng hóa học xảy ra khi chất ban đầu biến đổi và tạo ra các chất mới.
- Ví dụ:
+ Khi đun nóng đường trong ống nghiệm, đường trắng sẽ biến thành chất màu đen, gọi là than, đồng thời có nước ngưng tụ trên thành ống nghiệm. Đây là hiện tượng hóa học vì đường đã chuyển hóa thành hai chất mới là than và nước.
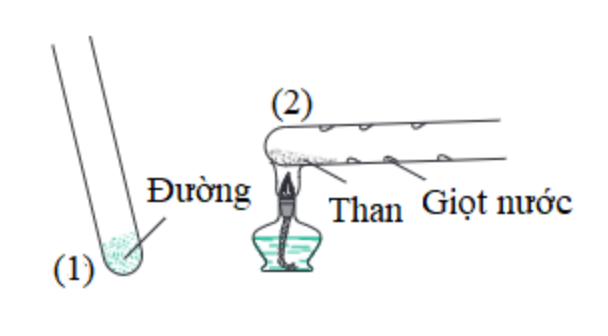
Hình 2: Thực nghiệm đun nóng đường
+ Khi lưu huỳnh cháy trong không khí, nó tạo ra khí lưu huỳnh đioxit có mùi hắc, đây là một ví dụ của hiện tượng hóa học.

Hình 3: Lưu huỳnh đang cháy trong không khí
II. PHẢN ỨNG HÓA HỌC
Phản ứng hóa học là quá trình chuyển đổi chất phản ứng thành các chất sản phẩm mới.
Trong các phản ứng hóa học, các nguyên tử không bị mất đi mà chỉ thay đổi cách liên kết, dẫn đến sự chuyển đổi từ phân tử này sang phân tử khác.

Chất phản ứng trong ví dụ là: CaCO3
Các sản phẩm của phản ứng là: CaO và CO2
Dấu hiệu nhận diện phản ứng hóa học gồm sự hình thành chất mới có các đặc điểm khác biệt như màu sắc, mùi, vị, tỏa nhiệt, phát sáng, v.v.
III. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
1. Định luật bảo toàn khối lượng
- Định luật này được phát hiện độc lập bởi hai nhà khoa học Lô-mô-nô-xốp (Nga, 1711-1765) và La-voa-diê (Pháp, 1743-1794).
- Nội dung của định luật là:
“Tổng khối lượng của các chất sản phẩm trong một phản ứng hóa học luôn bằng tổng khối lượng của các chất phản ứng.”
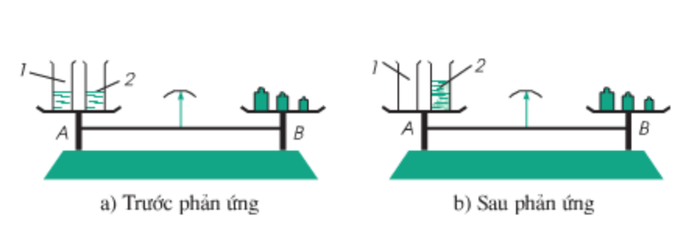
Hình 1: Phản ứng hóa học trong cốc đặt trên đĩa cân
- Giải thích định luật:
Trong phản ứng hóa học, chỉ có sự thay đổi trong liên kết giữa các nguyên tử, liên quan đến số electron. Số lượng nguyên tử của mỗi nguyên tố và khối lượng của chúng không thay đổi, do đó tổng khối lượng các chất luôn được bảo toàn.
2. Ứng dụng định luật
- Phương pháp thực hiện:
+ Để áp dụng định luật, chúng ta cần chuyển nội dung thành công thức. Ví dụ với phản ứng:
A + B → C + D
Lúc này, công thức về khối lượng được biểu diễn như sau:
mA + mB = mC + mD
Trong đó: mA, mB, mC, mD là khối lượng của các chất tương ứng.
⇒ Kết luận: Trong một phản ứng hóa học với n chất (bao gồm cả chất phản ứng và sản phẩm), nếu biết khối lượng của (n – 1) chất, ta có thể tính được khối lượng của chất còn lại.
IV. PHƯƠNG TRÌNH HÓA HỌC:
Phương trình hóa học là cách diễn tả phản ứng hóa học thông qua các công thức hóa học.
Ví dụ: Phản ứng giữa sắt và oxi:
3Fe + 2O2 → Fe3O4
- Các bước để lập phương trình hóa học:
+ Bước 1: Viết sơ đồ phản ứng: Al + O2 → Al2O3
+ Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố: Al + O2 → 2Al2O3
+ Bước 3: Viết phương trình hóa học cân bằng: 4Al + 3O2 → 2Al2O3
CHƯƠNG 3: MOL VÀ TÍNH TOÁN HÓA HỌC
I. Khái Niệm Mol
1. Mol là gì?
Mol là đơn vị đo lường số lượng chất, tương ứng với 6.10^23 nguyên tử hoặc phân tử của chất đó.
Con số 6.10^23 được gọi là số Avogađro, ký hiệu là N.
2. Khối lượng mol
Khối lượng mol (ký hiệu M) của một chất là khối lượng tính bằng gam của số nguyên tử hoặc phân tử tương đương với một mol của chất đó.
Đơn vị: g/mol
Khối lượng mol có giá trị số học tương đương với nguyên tử khối hoặc phân tử khối của chất đó.
3. Thể tích mol của khí
Thể tích mol của khí là không gian mà một mol phân tử khí đó chiếm giữ.
Ở điều kiện tiêu chuẩn (0°C và 1 atm), một mol khí có thể tích là 22,4 lít.
II. Chuyển đổi giữa khối lượng, thể tích và lượng chất
1. Chuyển đổi giữa lượng chất và khối lượng
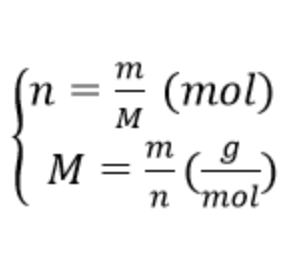
2. Chuyển đổi giữa lượng chất và thể tích khí
V = 22,4 x n (lít) ⇒ n = V/22,4 (mol)
III. Tỉ khối của chất khí
1. Tỉ khối của khí
a. So sánh giữa khí A và khí B
Dùng để so sánh trọng lượng khí A với khí B theo tỷ lệ
Kí hiệu dA/B
Công thức tính dA/B = MA/MB
Nếu dA/B > 1, khí A nặng hơn khí B
Nếu dA/B = 1, trọng lượng khí A và khí B là như nhau
dA/B < 1 cho thấy khí A nhẹ hơn khí B
b. Khí A so với không khí
Tương tự như phần a, trong trường hợp này, không khí được coi như khí B với Mkk = 29(g/mol)
Kí hiệu dA/kk
2. Ví dụ
So sánh trọng lượng của khí oxi với không khí
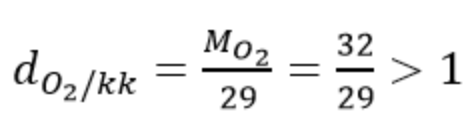
⇒ Oxi nặng hơn không khí gấp 32/29 lần
CHƯƠNG 4: OXI VÀ KHÔNG KHÍ
I. Đặc điểm của oxi
1. Đặc điểm vật lý
Là khí không màu, không mùi, ít hòa tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở nhiệt độ -183oC và có màu xanh nhạt khi ở dạng lỏng.
2. Đặc điểm hóa học
Oxi là một phi kim đơn chất rất phản ứng, đặc biệt khi ở nhiệt độ cao, dễ dàng phản ứng với nhiều phi kim, kim loại và hợp chất.
a. Phản ứng với phi kim (S, N, P…)
S + O2 "- to "> SO2 (cháy với ngọn lửa xanh nhạt)
b. Phản ứng với kim loại
Oxi có thể phản ứng với hầu hết các kim loại khi được nung nóng để tạo thành oxit, ngoại trừ một số kim loại như Au, Ag, Pt không phản ứng với oxy
2Mg + O2 "- to "> 2MgO
2Zn + O2 "- to "> 2ZnO
3Fe + 2O2 "- to "> Fe3O4
c. Phản ứng với các hợp chất
2H2S + 3O2 "- to "> 2SO2 + 2H2O
C2H4 + 3O2 "- to "> 2CO2 + 2H2O
II. Oxi hóa - Phản ứng tổng hợp - Ứng dụng của oxy
1. Quá trình oxi hóa
Đây là hiện tượng khi oxy phản ứng với một chất
2. Phản ứng tổng hợp
Phản ứng tổng hợp là quá trình hóa học trong đó một chất mới được hình thành từ hai hoặc nhiều chất ban đầu.
Quá trình này cần nâng nhiệt độ để bắt đầu phản ứng, các chất sẽ cháy và tỏa ra nhiều nhiệt, được gọi là phản ứng tỏa nhiệt.
III. Oxit
1. Khái niệm
Oxit là một hợp chất bao gồm hai nguyên tố, trong đó một nguyên tố là oxy.
2. Các loại:
a. Oxit axit:
Thường là oxit của các phi kim và liên quan đến một axit.
Ví dụ: SO3 tương ứng với axit H2SO4.
b. Oxit bazơ
Thường là oxit của kim loại và tương ứng với một bazơ.
Na2O tương ứng với NaOH.
3. Quy tắc đặt tên:
Tên oxit = tên nguyên tố + oxit
Khi kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
Ví dụ:
FeO: sắt (II) oxit
Công thức Fe2O3 được gọi là sắt (III) oxit
Khi phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Sử dụng các tiền tố để chỉ số nguyên tử
Mono: một + Di: hai
Tri: ba + Tetra: bốn + Penta: năm
Ví dụ: CO: cacbon monoxit
CO2: cacbon đioxit
SO2: lưu huỳnh đioxit
IV. Sản xuất khí oxi - Phản ứng phân hủy
1. Phương pháp điều chế oxi
a. Trong phòng thí nghiệm
Đun nóng các hợp chất chứa oxi dễ phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi sẽ được giải phóng ra.
2KMnO4 "- to "> K2MnO4 + MnO2 + O2
2KClO3 chuyển hóa thành 2KCl và 3O2
b. Trong lĩnh vực công nghiệp
Sản xuất từ không khí:
làm lạnh không khí ở nhiệt độ rất thấp và áp suất cao, thu được Nitơ (-196°C) trước và sau đó là Oxy (-183°C)
Sản xuất từ nước: qua quá trình điện phân nước
2. Phản ứng phân hủy
Đây là loại phản ứng hóa học mà từ một chất ban đầu sinh ra nhiều chất mới.
Ví dụ: 2KMnO4 chuyển hóa thành K2MnO4, MnO2 và O2
V. Không khí - Quá trình cháy
1. Không khí
Không khí là hỗn hợp khí với oxi chiếm khoảng 1/5 thể tích. Cụ thể, oxi chiếm 21% thể tích, nitơ 78%, và các khí khác chiếm 1%
2. Cháy và oxi hóa chậm
Cháy là quá trình oxi hóa tạo ra nhiệt và ánh sáng
Oxi hóa chậm là quá trình oxi hóa tỏa nhiệt nhưng không phát sáng
Trong những điều kiện nhất định, oxi hóa chậm có thể chuyển thành quá trình cháy
V. Sản xuất khí oxi - Phản ứng phân hủy
1. Sản xuất oxi
a. Trong phòng thí nghiệm
Nung nóng các hợp chất chứa oxi dễ phân hủy ở nhiệt độ cao, chẳng hạn như KMnO4 hoặc KClO3 trong ống nghiệm, sẽ giải phóng oxi theo các phản ứng:
2KMnO4 biến thành K2MnO4, MnO2 và O2
2KClO3 biến thành 2KCl và 3O2
b. Trong công nghiệp
Sản xuất từ không khí:
Làm lạnh không khí ở nhiệt độ rất thấp và áp suất cao để tách Nitơ (-196°C) trước, rồi thu được Oxy (-183°C)
Sản xuất từ nước: qua quá trình điện phân nước
2. Phản ứng phân hủy
Là loại phản ứng hóa học trong đó một chất ban đầu tạo ra nhiều chất mới.
Ví dụ: 2KMnO4 chuyển hóa thành K2MnO4, MnO2 và O2
CHƯƠNG 5: HIDRO - NƯỚC
I. Đặc điểm - Ứng dụng của Hiđro
1. Đặc tính vật lý
Là khí không màu, không mùi và không vị, là khí nhẹ nhất, ít hòa tan trong nước
2. Đặc tính hóa học
a. Phản ứng với oxi
2H2 + O2 chuyển thành 2H2O
Hỗn hợp hiđro và oxi có thể gây nổ nếu trộn theo tỷ lệ thể tích 2:1
b. Phản ứng với đồng oxit CuO
Bột CuO màu đen chuyển hóa thành lớp đồng màu đỏ gạch và tạo ra những giọt nước trên thành cốc
H2 + CuO chuyển thành Cu và H2O
II. Sản xuất khí Hiđrô - Phản ứng thế
1. Sản xuất hiđrô
a. Trong phòng thí nghiệm
Cho các kim loại như Al, Fe tác dụng với dung dịch axit như HCl hoặc H2SO4
Ví dụ: Fe + 2HCl → FeCl2 + H2
b. Trong lĩnh vực công nghiệp
Hydro có thể được sản xuất thông qua quá trình điện phân nước hoặc dùng than để khử oxy trong H2O
Phương trình hóa học: 2H2O --> 2H2 + O2
2. Phản ứng thế
Phản ứng thế là loại phản ứng hóa học xảy ra giữa một đơn chất và một hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
Ví dụ: Fe + 2HCl → FeCl2 + H2
III. Nước
1. Tính chất vật lý
Nước là một chất lỏng trong suốt, không màu (mặc dù nước dày có thể có màu xanh da trời), không mùi và không vị. Nó sôi ở 100°C (p = 760 mmHg) và đông đặc ở 0°C.
Nước có khả năng hòa tan nhiều loại chất rắn (như muối, đường), chất lỏng (như cồn, axit), và khí (như HCl)
2. Tính chất hóa học
Tác động với kim loại: nước có khả năng phản ứng với một số kim loại ở nhiệt độ bình thường như Ca, Ba, K,…
CHƯƠNG 6: DUNG DỊCH
I. Oxit
1. Khái niệm
Oxit là hợp chất bao gồm hai nguyên tố, trong đó một nguyên tố là oxi
2. Phân loại:
a. Oxit axit:
Thường là oxit của phi kim và liên kết với một axit tương ứng
Ví dụ: SO3 liên kết với axit H2SO4
b. Oxit bazơ
Thường là oxit của kim loại và có khả năng tạo ra một bazơ tương ứng
NaO tương ứng với NaOH
3. Quy tắc đặt tên:
Tên oxit = tên nguyên tố + từ 'oxit'
Khi kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + 'oxit'
Ví dụ:
FeO được gọi là sắt (II) oxit
Công thức Fe2O3 được gọi là sắt (III) oxit
Khi phi kim có nhiều hóa trị
Tên gọi = tên phi kim + 'oxit'
Sử dụng các tiền tố để chỉ số nguyên tử
Mono: một + Di: hai
Tri: ba + Tetra: bốn + Penta: năm
Ví dụ: CO: cacbon monooxit
CO2: cacbon đioxit
SO2: lưu huỳnh đioxit
II. Bazơ
1. Định nghĩa:
Phân tử bazơ bao gồm một nguyên tử kim loại liên kết với một hoặc nhiều nhóm hidroxit (-OH).
Công thức hóa học: M(OH)n, trong đó n là số hóa trị của kim loại
2. Quy tắc đặt tên:
Tên bazơ = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + 'hiđroxit'
Ví dụ: Fe(OH)2 được gọi là sắt (II) hiđroxit
3. Phân loại
Bazơ hòa tan trong nước được gọi là kiềm. Ví dụ: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không hòa tan trong nước. Ví dụ: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
III. Muối
1. Định nghĩa
Phân tử muối bao gồm một hoặc nhiều nguyên tử kim loại liên kết với một hoặc nhiều gốc axit.
Công thức hóa học: gồm hai phần: kim loại và gốc axit
Ví dụ: Na2SO4, CaCO3,…
2. Quy tắc đặt tên
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4: là natri sunfat
3. Phân loại
- Muối trung hòa: là loại muối trong gốc axit không còn nguyên tử hiđro nào có thể được thay thế bằng nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là loại muối mà gốc axit còn chứa nguyên tử hiđro H chưa được thay thế bằng nguyên tử kim loại. Số nguyên tử hiđro đã thay thế tương đương với hóa trị của gốc axit.
VD: NaHSO4, NaHS, NaHSO3,…
