1. Quang Hợp
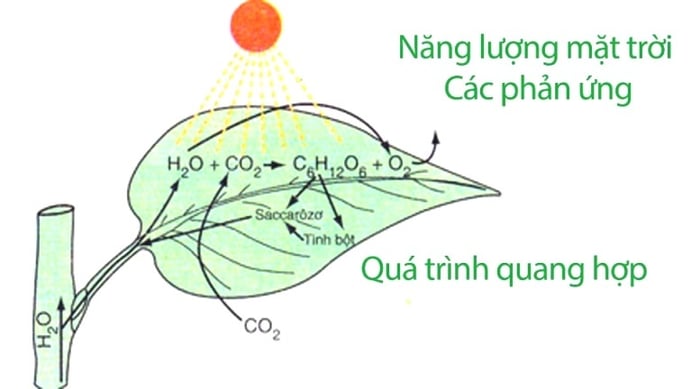
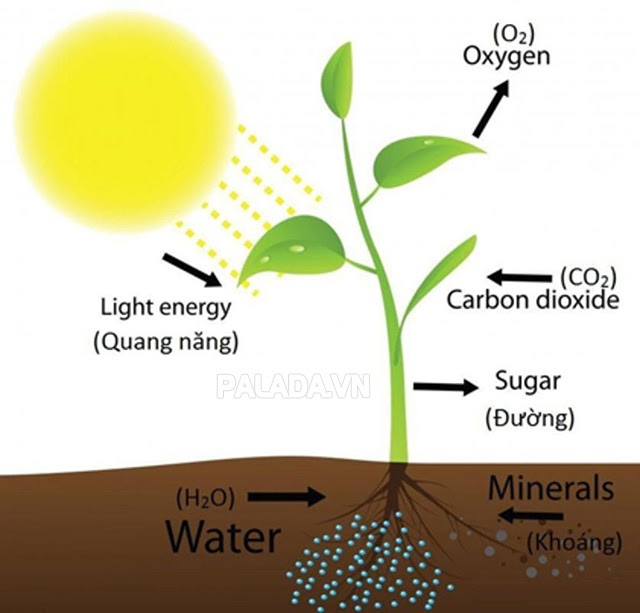
Quang Hợp là một trong những phản ứng hóa học phổ biến hàng ngày và đóng vai trò quan trọng trong cuộc sống con người, thực vật và động vật. Quang hợp là quá trình thu nhận năng lượng ánh sáng mặt trời bởi thực vật và vi khuẩn để tạo ra các hợp chất hữu cơ như đường, lưu trữ năng lượng từ carbon dioxide và nước.
Quang hợp giúp duy trì nồng độ oxy và cung cấp chất hữu cơ và năng lượng cho sự sống. Tất cả các sinh vật phụ thuộc vào quang hợp, chúng là nguồn thức ăn, năng lượng và nguyên liệu quan trọng cho con người và động vật. Quang hợp còn đóng vai trò quan trọng trong việc điều hòa không khí và ngăn chặn hiệu ứng nhà kính, ổn định khí hậu.
Phương trình tổng quát của quang hợp:
6 CO2 + 12 H2O →→ C6H12O6 + 6 O2 + 6 H2O
(theo MT, diệp lục)
2. Hô Hấp Kị Khí
Hô Hấp Kị Khí hay còn gọi là hô hấp yếm khí là quá trình phân giải cacbonhidrat để thu năng lượng cho tế bào, chấp nhận electron cuối cùng của chuỗi truyền electron là một phân tử vô cơ không phải là oxi phân tử. Ví dụ chất nhận electron cuối cùng là NO3 trong hô hấp nitrat, SO4 trong hô hấp sunphat.
Những chất nhận electron cuối này có khả năng khử kém hơn O2, có nghĩa là có năng lượng được sản sinh ra trên mỗi phân tử bị ôxi hóa ít hơn. Vì vậy, ta có thể nói rằng, hô hấp yếm khí kém hiệu quả hơn hô hấp hiếu khí.
Nguyên liệu được sử dụng trong hô hấp kị khí là đường đơn, trải qua quá trình đường phân và cho ra sản phẩm cuối cùng là ATP. Quá trình này xảy ra ở môi trường không có O2 tại màng sinh chất của sinh vật nhân thực (Không có bào quan ty thể). Hô hấp yếm khí được sử dụng chủ yếu bởi các vi khuẩn và cổ khuẩn sống trong môi trường thiếu thốn ôxi. Nhiều sinh vật yếm khí thuộc trong dạng yếm khí bắt buộc, tức là chúng sẽ chỉ hô hấp được với những hợp chất yếm khí và sẽ chết nếu có sự hiện diện của ôxi.
Hô hấp yếm khí là một thành phần quan trọng của chu trình nitơ, sắt, lưu huỳnh và carbon toàn cầu thông qua việc giảm các oxy hóa của nitơ, lưu huỳnh và carbon thành các hợp chất khử nhiều hơn. Chu trình hóa sinh của các hợp chất này, phụ thuộc vào quá trình hô hấp yếm khí, tác động đáng kể đến chu trình carbon và sự nóng lên toàn cầu.
Hô hấp yếm khí xảy ra trong nhiều môi trường, bao gồm trầm tích nước ngọt và biển, đất, tầng ngậm nước ngầm, môi trường dưới bề mặt sâu và màng sinh học. Ngay cả môi trường, chẳng hạn như đất, có chứa oxy cũng có môi trường vi mô thiếu oxy do đặc tính khuếch tán chậm của khí oxy.
Một ví dụ về tầm quan trọng sinh thái của hô hấp yếm khí là việc sử dụng nitrat làm chất nhận điện tử cuối, hoặc khử nitrat hòa tan, là con đường chính mà nitơ cố định được đưa trở lại khí quyển dưới dạng khí nitơ phân tử. Một ví dụ khác là methanogenesis, một dạng hô hấp carbonate, được sử dụng để sản xuất khí metan bằng cách tiêu hóa yếm khí. Mêtan sinh học được sử dụng như là một thay thế bền vững cho nhiên liệu hóa thạch.
Phương trình hóa học:
C6H12O6 →→ 2C2H5OH + 2CO2+ năng lượng.

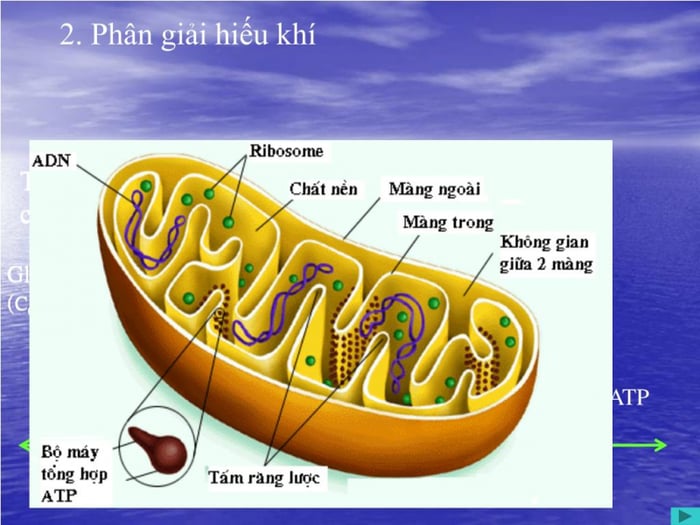
3. Quá trình Hô Hấp Hiếu Khí
Hô Hấp Hiếu Khí là quá trình diễn ra trong môi trường có O2, chỉ xảy ra khi có sự tham gia của O2 trong quá trình hô hấp. Hô Hấp Hiếu Khí, cùng với Hô Hấp Kị Khí, là một phần quan trọng của quá trình hô hấp ở thực vật.
Hô Hấp Hiếu Khí là quá trình phân giải nguyên liệu để tạo ra năng lượng cung cấp cho các hoạt động sống của cơ thể. Nguyên liệu được sử dụng là đường đơn, trải qua giai đoạn đường phân và cho ra sản phẩm cuối cùng là ATP. Điểm quan trọng của Hô Hấp Hiếu Khí là cần môi trường có O2 để thực hiện quá trình hô hấp.
Hô Hấp Hiếu Khí đóng vai trò quan trọng trong tổng hợp ATP và cung cấp nguyên liệu quan trọng cho các phản ứng tổng hợp. Hệ số hô hấp là tỉ lệ giữa số phân tử CO2 thải ra và số phân tử O2 hấp thụ trong quá trình hô hấp. Hệ số này cho biết loại nguyên liệu mà cây đang hô hấp và từ đó có thể đánh giá tình trạng hô hấp của cây.
Phương trình hóa học:
C6H12O6 + 6O2 → 6CO2 + 6H2O + Năng lượng (36 ATP).


4. Gỉ Sét
Theo thời gian, bề mặt bên ngoài của thanh sắt phát triển một lớp phủ màu đỏ, dễ bong gọi là gỉ sét. Đây là một ví dụ điển hình về phản ứng oxy hóa. Các ví dụ hàng ngày khác bao gồm sự hình thành của verdigris hay còn gọi là gỉ đồng (là chất xanh lục tạo thành trên các bề mặt của đồng cỏ, đồng thau và đồng thiếc là những dạng gỉ trên bề mặt) và sự xỉn màu của bạc.
Rỉ sét (hay gỉ sét) là sắt bị oxy hóa. Rỉ sét được hình thành khi sắt kết hợp với oxy trong môi trường có nước hoặc không khí ẩm. Trên bề mặt của sắt thép bị rỉ hình thành những lớp vảy rất dễ vỡ, thường có màu nâu, nâu đỏ hoặc đỏ. Lớp rỉ này không bảo vệ sắt bên trong. Nếu có đủ thời gian, oxy và nước, bất kỳ khối sắt nào cũng sẽ bị rỉ hoàn toàn và phân hủy.
Nguyên nhân của hiện tượng gỉ sét do sắt hoặc hợp kim sắt (như thép…) tiếp xúc với oxy và độ ẩm trong thời gian dài, tạo thành một hợp chất mới gọi là oxit sắt hay rỉ sắt. Chất xúc tác chính cho quá trình rỉ sét là nước. Cấu trúc của sắt hoặc thép có vẻ chắc chắn, nhưng phân tử nước có thể xâm nhập vào các lỗ nhỏ và vết nứt trong bất kỳ kim loại nào kể cả sắt, sự kết hợp của nguyên tử hidro có trong nước với các nguyên tố khác để tạo thành axit, gây ăn mòn sắt và làm cho sắt bị phơi ra nhiều hơn. Nếu trong môi trường nước biển, sự ăn mòn có thể xảy ra nhanh hơn. Trong khi đó, các nguyên tử oxy kết hợp với các nguyên tử sắt để tạo thành oxit sắt hay rỉ sắt, chúng làm cho sắt trở nên yếu và làm cho cấu trúc của sắt trở nên giòn và xốp. Do đó, hiện tượng gỉ sét sẽ gia tăng và thúc đẩy quá trình ăn mòn, điều này làm cho công việc bảo dưỡng trở nên quan trọng.
Dưới đây là phương trình hóa học mô tả quá trình rỉ sét của sắt: Fe + O2 + H2O → Fe2O3 . XH2O


5. Sự Cháy
Một cách đơn giản, sự hoạt động oxi hóa là quá trình tương tác giữa một chất với oxy tạo ra ngọn lửa. Ngọn lửa quen thuộc nhất đối với chúng ta là khi đun nấu bằng gas, than, hoặc dầu hỏa, trong không gian lãng mạn với ngọn nến, hoặc khi ai đó châm điếu thuốc bằng diêm hay bật lửa. Đây là một phản ứng oxi hóa - khử nhiệt độ cao giữa chất cháy và chất oxi hóa, thường là oxy khí trong không khí, tạo ra các sản phẩm oxi hóa thường dạng hơi, tạo thành khói. Sự hoạt động oxi hóa tạo ra ngọn lửa và tạo nhiệt độ đủ để duy trì quá trình tự nhiên. Hầu hết mọi thứ đều có thể bị oxi hóa, do đó việc phòng cháy và chữa cháy rất quan trọng.
Sự hoạt động oxi hóa có thể được nhận biết qua mùi: cháy điện, cao su, sợi bông,... mùi thơm: mật, đường, mùi khói độc tố: SO2, SO3, Cl2. Ngoài ra, sự hoạt động oxi hóa luôn đi kèm với khói. Khói là sản phẩm của sự cháy, được tạo ra từ các chất cháy. Các chất cháy khác nhau tạo ra khói có màu sắc khác nhau, phụ thuộc vào điều kiện có đủ hay thiếu không khí. Ngoài ra, sự hoạt động oxi hóa có đặc điểm như ánh sáng và âm thanh nổ.
Ví dụ về phản ứng oxi hóa của propan, thường xuất hiện trong bếp ga và một số lò sưởi:
C3H8 + 5O2 → 4H2O + 3CO2 + năng lượng.


6. Thiết Bị Di Động
Trong cuộc sống hàng ngày, chúng ta thường xuyên sử dụng thiết bị di động, như quạt, đồng hồ, hoặc đồ chơi trẻ con... Thiết Bị Di Động là những công cụ linh hoạt giúp chúng ta tiện lợi trong các hoạt động hàng ngày.
Các thiết bị di động hoạt động dựa trên nguồn năng lượng di động. Năng lượng này có thể được tạo ra thông qua phản ứng điện hóa hoặc phản ứng oxi hóa khử, biến đổi năng lượng hóa học thành điện năng. Phản ứng oxi hóa tự nhiên diễn ra trong các tế bào điện, trong khi phản ứng hóa học nhân tạo xảy ra trong pin. Cơ bản, thiết bị di động có các thành phần tương tự như ắc quy, nhưng chúng hoạt động theo cách khác. Pin thông thường dừng hoạt động khi hóa chất tiêu thụ hết và cần phải được nạp lại, trong khi thiết bị di động không tích trữ nhiên liệu và tiếp tục hoạt động khi có nguồn năng lượng từ bên ngoài. So với pin truyền thống, thiết bị di động tạo ra ít hoặc không tạo ra chất thải gây ô nhiễm môi trường, với lượng nước phát sinh sau phản ứng là nước sạch có thể uống được.


Trong thực tế, có vô số phép màu hóa học khi các hóa chất kết hợp với nhau. Những phản ứng hóa học này không chỉ dễ thực hiện mà còn có nhiều ứng dụng thú vị trong cuộc sống hàng ngày. Việc kết hợp giấm và baking soda để tạo ra ngọn lửa nhân tạo, hoặc sữa với bột nở trong các công thức nấu ăn, có thể tạo ra sản phẩm với kích thước gấp đôi hoặc tạo ra các phản ứng hoán vị độc đáo. Các thành phần kết hợp để tạo ra khí carbon dioxide và nước. Carbon dioxide tạo nên bong bóng trong ngọn lửa và giúp chiếc bánh nở lên.
Những phản ứng hóa học kiểu hoán vị này có vẻ đơn giản nhưng lại mang lại nhiều kết quả bất ngờ. Ví dụ, phản ứng giữa baking soda và giấm không chỉ tạo nên hiệu ứng sủi bọt mà còn có công dụng làm sạch. Baking soda, một loại muối nở, chứa thành phần tẩy rửa có thể loại bỏ các vết ố và dơ bẩn trên đồ vật. Giấm, một chất axit mạnh, cũng là chất tẩy rửa hiệu quả. Khi hai hợp chất này kết hợp, tạo ra phản ứng với khí (sủi bọt) giúp loại bỏ các vết bẩn một cách hiệu quả.
Dưới đây là phương trình hóa học tổng quát cho phản ứng giữa baking soda và giấm: HC2H3O2 (aq) + NaHCO3 (aq) → NaC2H3O2 (aq) + H2O + CO2 (g)
7. Phép Màu Hóa Học


8. Hòa Trộn Axit và Bazo