1. Chất nào được xem là muối axit?
Trong số các chất dưới đây, chất nào là muối axit?
A. KNO3 B. NaHSO4 C. NaCl D. Na2SO4
Đáp án đúng là B. NaHSO4
Giải thích: NaHSO4 sở hữu đặc điểm hóa học của muối axit.
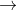
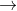
2. Muối axit là gì?
a. Axit đa chức
Axit đa chức là axit có nhiều hơn một nguyên tử H có thể thay thế bởi kim loại, hoặc có khả năng nhường nhiều proton khi phân li trong dung dịch. Ví dụ: H2SO4, H3PO4, H2CO3, (HOOC)2,...
Axit sunfuric khi hòa tan trong dung dịch phân li qua hai giai đoạn, tạo ra hai gốc axit khác nhau là HSO4 và SO4:
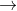
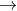
Axit photphoric trong dung dịch phân li qua ba giai đoạn, tạo ra ba ion axit khác nhau: H2PO4, HPO4, và PO4.
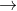
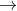
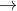
Trong phản ứng trung hòa, nguyên tử kim loại sẽ dần thay thế từng nguyên tử H trong axit đa chức:
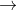
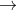
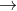
Các quá trình (1), (2), (3) cho thấy khi gốc axit tiếp tục phân li ra proton, chứng tỏ các gốc axit này có tính axit.
Các quá trình (4), (5) chỉ ra rằng các muối NaH2PO4 và Na2PO4, vì chứa gốc axit có tính axit, vẫn tiếp tục phản ứng với kiềm để tạo ra muối và axit mới. Những muối này cũng mang tính chất axit, nên được gọi là muối axit, vừa là muối vừa là axit.
b. Muối axit
Dựa trên kiến thức về axit đa chức và các phản ứng đã nêu trong phần 2a, chúng ta định nghĩa muối axit là muối của một kim loại với một gốc axit mà gốc axit đó vẫn chứa nguyên tử H có tính axit (có khả năng phân li thành proton trong dung dịch - các phản ứng (1), (2), (3); hoặc có thể bị thay thế bởi nguyên tử kim loại - các phản ứng (4), (5)).
Vì vậy, chỉ có axit đa chức mới tạo ra muối axit, ngoại trừ các muối amoni và các dẫn xuất, do nhóm amoni NH4 hoặc dẫn xuất dạng NR3H (R là một gốc hydro cacbon, ví dụ) có tính axit (có thể phân li thành proton và có thể bị thay thế bởi nguyên tử kim loại):
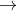
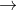
Các muối axit thường gặp bao gồm muối của kim loại kiềm, kim loại kiềm thổ, và các axit tạo muối axit phổ biến như axit cacbonic, axit sunfuro, axit sunfuric, axit photphoric,...
3. Tính chất hóa học của muối axit
a. Phản ứng trung hòa
Như một axit, muối axit phản ứng với bazơ để tạo ra muối và nước trong phản ứng trung hòa:
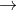
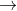
Lưu ý: Khi muối axit được thêm vào môi trường kiềm, nó sẽ ngay lập tức bị trung hòa, dẫn đến sự hình thành muối trung hòa tương ứng với axit ban đầu.
b. Phản ứng với muối
Như một muối, muối axit phản ứng với muối khác để tạo ra muối mới (muối của axit mạnh) và axit mới. Sản phẩm phản ứng thường bao gồm một chất ít tan, không ổn định, một chất bay hơi, hoặc một muối axit mới với gốc axit ít phân li (axit yếu).
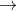
- NaHCO3 với gốc axit HCO3 phân li yếu trong dung dịch khi Na2CO3 vẫn còn dư.
- Khi NaHSO4 đã hết và Na2CO3 vẫn còn dư, chỉ có một nguyên tử kim loại trong muối axit yếu ban đầu Na2CO3 bị thay thế.
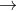
- Khi NaHSO4 còn dư, cả hai nguyên tử kim loại trong muối axit yếu ban đầu Na2CO3 đều bị thay thế.
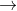
Vậy phản ứng này có xảy ra không?
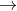
Phản ứng này không xảy ra, vì HCl là axit mạnh hơn axit cacbonic, nên nó sẽ ngay lập tức hòa tan BaCO3.
Phản ứng (6) không xảy ra không phải vì HCl yếu hơn H2SO4 (cả hai đều là axit mạnh), mà vì BaSO4 không hòa tan trong môi trường axit.
c. Phản ứng giữa hai muối axit
Khi hai muối axit phản ứng với nhau, một chất sẽ hoạt động như axit và một chất sẽ hoạt động như muối. Tất nhiên, muối axit của axit mạnh sẽ đóng vai trò axit.
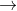
Trong phản ứng này, NaHSO4 giữ vai trò axit, trong khi NaHCO3 là muối của axit yếu. Do đó, sản phẩm là muối của axit mạnh (muối của 'muối' axit trở thành muối trung hòa vì nguyên tử H đã bị thay thế) và axit yếu cacbonic không ổn định, phân hủy thành CO2.
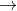
d. Phản ứng giữa muối axit và axit
Khi muối axit phản ứng với chính axit tương ứng, sản phẩm có thể là muối axit với nhiều nguyên tử H axit hơn trong phân tử.
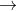
Muối axit của axit yếu phản ứng với axit mạnh hơn để tạo ra muối mới và axit mới yếu hơn, kèm theo chất kết tủa, ít phân ly, hoặc bay hơi. Lúc này, muối axit hoạt động như một muối.
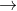
e. Phản ứng nhiệt phân muối axit
Khi đun nóng dung dịch muối bicacbonat, có thể tạo ra muối cacbonat trung hòa:
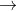
g. Điều chế muối axit
- Kết hợp axit hoặc oxit axit với bazơ tương ứng theo tỉ lệ thích hợp:
4. Một số bài tập liên quan
Bài 1: Xác định vai trò của NaHSO4 như một axit. Viết các phương trình phản ứng khi NaHSO4 phản ứng với dung dịch NaHCO3, Na2CO3, BaCl2, Ba(HCO3)2, Na2S.
Bài 2: Hòa tan m (g) hỗn hợp Na2CO3, KHCO3 vào nước và thu được 400 ml dung dịch A. Thêm từ từ 100 ml dung dịch HCl 1,5 M vào dung dịch A, ta thu được dung dịch B và 1,008 lít khí ở đktc. Khi cho B phản ứng với Ba(OH)2 dư, ta thu được 29,55 g kết tủa. Tính m và thể tích CO2 (đktc) thoát ra khi dung dịch A phản ứng với 100 ml HCl 1,5 M.
Bài 3: Trong các chất sau, dãy nào là muối axit?
A. KHCO3, CaCO3, Na2CO3.
B. Ba(HCO3)2, NaHCO3, Ca(HCO3)2.
C. Ca(HCO3)2, Ba(HCO3)2, BaCO3.
D. Mg(HCO3)2, Ba(HCO3)2, CaCO3.
Bài 4: Hoàn thiện các phương trình phản ứng sau:
Bài 5: Kết hợp 0,1 mol dung dịch CuSO4 với 0,3 mol NaOH, lọc và rửa kết tủa, sau đó nung đến khối lượng không thay đổi, ta thu được m gam chất rắn. Tính giá trị của m.
Bài 6: Thêm 200 g dung dịch Ba(OH)2 17,1 % vào 500 g dung dịch hỗn hợp (NH4)2SO4 1,32 % và CuSO4 2%. Sau khi hoàn tất phản ứng, thu được khí A, kết tủa B và dung dịch C.
a, Tính thể tích khí A ở điều kiện tiêu chuẩn
b, Sau khi rửa sạch và nung kết tủa B ở nhiệt độ cao đến khi khối lượng không thay đổi, ta thu được bao nhiêu gam chất rắn?
c, Tính nồng độ phần trăm của các chất trong dung dịch C.
Bài 7: Hòa 216,55 gam hỗn hợp muối KHSO4 và Fe(NO3)3 vào nước dư để tạo dung dịch A. Sau đó, thêm m gam hỗn hợp B bao gồm Mg, Al, Al2O3 và MgO vào dung dịch A và khuấy cho đến khi phản ứng hoàn toàn. B tan hết, thu được dung dịch C chỉ chứa các muối và 2,016 lít hỗn hợp khí D với tổng khối lượng 1,84 gam, gồm 5 khí (đktc) trong đó thể tích của H2, N2O, NO2 lần lượt là 4/9, 1/9 và 1/9. Thêm BaCl2 dư vào C để xuất hiện 356,49 gam kết tủa trắng. Biết rằng trong B, oxi chiếm 64/205 về khối lượng. Tính giá trị của m.
Đây là bài viết về muối axit. Mytour xin cảm ơn bạn đọc đã theo dõi.
